

ͼ2-3-1

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��Դ����Լ���ҷ�չ���̵�����֮һ���״��������ѵȱ���Ϊ2 1���͵���ɫ��Դ����ҵ��������Ȼ��Ϊ��Ҫԭ���������̼��ˮ������һ���������Ʊ��ϳ�����CO��H2�������Ƴɼ״��������ѣ�
��Դ����Լ���ҷ�չ���̵�����֮һ���״��������ѵȱ���Ϊ2 1���͵���ɫ��Դ����ҵ��������Ȼ��Ϊ��Ҫԭ���������̼��ˮ������һ���������Ʊ��ϳ�����CO��H2�������Ƴɼ״��������ѣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡ����һ��2011��2012ѧ��߶���ѧ�����п��Ի�ѧ���� ���ͣ�058
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮��ԭ��Ϊ��N2(g)��3H2(g)![]() 2NH3(g)����H����92.4 kJ/mol�ݴ˻ش��������⣺
2NH3(g)����H����92.4 kJ/mol�ݴ˻ش��������⣺
(1)Ϊ����߰����IJ��ʣ�����ѡ��ķ�����________(����ţ���ѡ�۷�)��
�������¶�
������ѹǿ
��ʹ�ô���
�ܼ�ʱ�����NH3
(2)�����ܱ������н��еĿ��淴Ӧ��N2(g)��3H2(g)![]() 2NH3(g)��������������£�˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬________��
2NH3(g)��������������£�˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬________��
��N2������Ӧ������NH3���淴Ӧ���ʵ�1/2
���ں��������£���������ѹǿ���ֲ���
��N2��H2��NH3�����ʵ���֮��Ϊ1��3��2
�ܵ�λʱ����ÿ����3 mol��H2��ͬʱ��2 mol��NH3����
��3 mol��N��N�����ѣ�ͬʱ��6 mol��N��H������
(3)һ�������£�NH3�ڹ̶�������ܱ������з����ֽⷴӦ(��H��0)����ƽ����ı��±��з�Ӧ����x����ƽ����ϵ����x����y�ݼ�����________(ѡ�����)��

��(1)��������Һ�У������(KIO3)���������ƿɷ������·�Ӧ��
2IO3����5SO32����2H+���ɵĵ�����õ�����Һ���飬���ݷ�Ӧ��Һ������ɫ�����ʱ���������÷�Ӧ�����ʣ�ijͬѧ���ʵ�����±���ʾ��

��ʵ���Ŀ����________������V1��________mL��
(2)���淴ӦC(s)��H2O(g)![]() H2(g)��CO(g)����H��0�ﵽƽ��ı�ijһ�������(���ı����ʵ�����������)����Ӧ����v��ʱ��t�Ĺ�ϵ����ͼ��
H2(g)��CO(g)����H��0�ﵽƽ��ı�ijһ�������(���ı����ʵ�����������)����Ӧ����v��ʱ��t�Ĺ�ϵ����ͼ��

��ͼ��t4��t6��ʱ����ƽ���ƶ�������������________��
��ͼ�б�ʾƽ��������CO�ĺ�����ߵ�һ��ʱ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��14�֣�ÿ��2�֣�
I���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��ԭ��Ϊ��
N2(g)+3H2(g) 2NH3(g) ��H= -92.4 kJ/mol �ݴ˻ش��������⣺
��1��Ϊ����߰����IJ��ʣ�����ѡ��ķ����� _______ ������ţ���ѡ�۷֣���
�� �����¶� �� ����ѹǿ �� ʹ�ô��� �� ��ʱ�����NH3
��2�������ܱ������н��еĿ��淴Ӧ��N2(g)+3H2(g)2NH3(g)��������������£�
˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬____________________________________��
��N2������Ӧ������NH3���淴Ӧ���ʵ�1/2
���ں��������£���������ѹǿ���ֲ���
��N2��H2��NH3�����ʵ���֮��Ϊ1��3��2
�ܵ�λʱ����ÿ����3mol H2��ͬʱ��2mol NH3����
��3mol N-N�����ѣ�ͬʱ��6mol N-H������
��3��һ�������£�NH3�ڹ̶�������ܱ������з����ֽⷴӦ����H��0������ƽ����ı��±��з�Ӧ����x����ƽ����ϵ����x����y�ݼ����ǣߣߣߣ�____________��ѡ����ţ���
| ѡ�� | a | b | c | d |
| x | �¶� | �¶� | ����H2�����ʵ��� | ����NH3�����ʵ��� |
| y | NH3�����ʵ��� | ƽ�ⳣ��K | NH3��ת���� | ���������ʵ����ܺ� |
II����1����������Һ�У������(KIO3)���������ƿɷ������·�Ӧ��
2IO3����5SO32����2H��===I2��5SO42����H2O
���ɵĵ�����õ�����Һ���飬���ݷ�Ӧ��Һ������ɫ�����ʱ���������÷�Ӧ�����ʡ�
ijͬѧ���ʵ�����±���ʾ��
|
| 0.01mol��L��1 KIO3������Һ(������)�����/mL | 0.01mol��L��1 Na2SO3��Һ�����/mL | H2O����� /mL | ʵ�� �¶� /�� | ��Һ������ɫʱ����ʱ��/s |
| ʵ��1 | 5 | V1 | 35 | 25 | --------- |
| ʵ��2 | 5 | 5 | 40 | 25 | ---------- |
| ʵ��3 | 5 | 5 | V2 | 0 | ----------- |
��ʵ���Ŀ����_______________________________________________________________
________________________________________________��
����V1=___________mL.
��2�����淴ӦC(s)+H2O(g) H2(g)+CO(g)����H>0�ﵽƽ��ı�ijһ������������ı����ʵ����������£�����Ӧ����
![]() ��ʱ��t�Ĺ�ϵ����ͼ��
��ʱ��t�Ĺ�ϵ����ͼ��
��ͼ��t4��t6��ʱ����ƽ���ƶ������������� ��
��ͼ�б�ʾƽ��������CO�ĺ�����ߵ�һ��ʱ���� ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012��ѧ����ʡ����һ�и߶���ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
��14�֣�ÿ��2�֣� I���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��ԭ��Ϊ��
I���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��ԭ��Ϊ��
N2(g)+3H2 (g)
(g)  2NH3(g) ��H=" -92.4" kJ/mol �ݴ˻ش��������⣺
2NH3(g) ��H=" -92.4" kJ/mol �ݴ˻ش��������⣺
��1��Ϊ����߰����IJ��ʣ�����ѡ��ķ����� _______������ţ���ѡ�۷֣���
�� �����¶� �� ����ѹǿ �� ʹ�ô��� �� ��ʱ�����NH3
��2�������ܱ������н��еĿ��淴Ӧ��N2(g)+3H2(g) 2NH3(g)��������������£�
2NH3(g)��������������£�
˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬____________________________________��
��N2������Ӧ������NH3���淴Ӧ���ʵ�1/2
���ں��������£���������ѹǿ���ֲ���
��N2��H2��NH3�����ʵ���֮��Ϊ1��3��2
�ܵ�λʱ����ÿ����3mol H2��ͬʱ��2mol NH3����
��3mol N-N�����ѣ�ͬʱ��6mol N-H������
��3��һ�������£�NH3�ڹ̶�������ܱ������з����ֽⷴӦ����H��0������ƽ����ı��±��з�Ӧ����x����ƽ����ϵ����x����y�ݼ����ǣߣߣߣ�____________��ѡ����ţ���
| ѡ�� | a | b | c | d |
| x | �¶� | �¶� | ����H2�����ʵ��� | ����NH3�����ʵ��� |
| y | NH3�����ʵ��� | ƽ�ⳣ��K | NH3��ת���� | ���������ʵ����ܺ� |
| | 0.01mol��L��1 KIO3������Һ(������)�����/mL | 0.01mol��L��1 Na2SO3��Һ�����/mL | H2O����� /mL | ʵ�� �¶� /�� | ��Һ������ɫʱ����ʱ��/s |
| ʵ��1 | 5 | V1 | 35 | 25 | --------- |
| ʵ��2 | 5 | 5 | 40 | 25 | ---------- |
| ʵ��3 | 5 | 5 | V2 | 0 | ----------- |
 H2(g)+CO(g)����H>0�ﵽƽ��ı�ijһ������������ı����ʵ����������£�����Ӧ����
H2(g)+CO(g)����H>0�ﵽƽ��ı�ijһ������������ı����ʵ����������£�����Ӧ���� ��ʱ��t�Ĺ�ϵ����ͼ��
��ʱ��t�Ĺ�ϵ����ͼ�� ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012��ѧ����ʡ�߶���ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
��14�֣�ÿ��2�֣�
I���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��ԭ��Ϊ��
N2(g)+3H2(g)
 2NH3(g) ��H= -92.4 kJ/mol �ݴ˻ش��������⣺
2NH3(g) ��H= -92.4 kJ/mol �ݴ˻ش��������⣺
��1��Ϊ����߰����IJ��ʣ�����ѡ��ķ����� _______ ������ţ���ѡ�۷֣���
�� �����¶� �� ����ѹǿ �� ʹ�ô��� �� ��ʱ�����NH3
��2�������ܱ������н��еĿ��淴Ӧ��N2(g)+3H2(g) 2NH3(g)��������������£�
2NH3(g)��������������£�
˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬____________________________________��
��N2������Ӧ������NH3���淴Ӧ���ʵ�1/2
���ں��������£���������ѹǿ���ֲ���
��N2��H2��NH3�����ʵ���֮��Ϊ1��3��2
�ܵ�λʱ����ÿ����3mol H2��ͬʱ��2mol NH3����
��3mol N-N�����ѣ�ͬʱ��6mol N-H������
��3��һ�������£�NH3�ڹ̶�������ܱ������з����ֽⷴӦ����H��0������ƽ����ı��±��з�Ӧ����x����ƽ����ϵ����x����y�ݼ����ǣߣߣߣ�____________��ѡ����ţ���
|
ѡ�� |
a |
b |
c |
d |
|
x |
�¶� |
�¶� |
����H2�����ʵ��� |
����NH3�����ʵ��� |
|
y |
NH3�����ʵ��� |
ƽ�ⳣ��K |
NH3��ת���� |
���������ʵ����ܺ� |
II����1����������Һ�У������(KIO3)���������ƿɷ������·�Ӧ��
2IO3����5SO32����2H��===I2��5SO42����H2O
���ɵĵ�����õ�����Һ���飬���ݷ�Ӧ��Һ������ɫ�����ʱ���������÷�Ӧ�����ʡ�
ijͬѧ���ʵ�����±���ʾ��
|
|
0.01mol��L��1 KIO3������Һ(������)�����/mL |
0.01mol��L��1 Na2SO3��Һ�����/mL |
H2O����� /mL |
ʵ�� �¶� /�� |
��Һ������ɫʱ����ʱ��/s |
|
ʵ��1 |
5 |
V1 |
35 |
25 |
--------- |
|
ʵ��2 |
5 |
5 |
40 |
25 |
---------- |
|
ʵ��3 |
5 |
5 |
V2 |
0 |
----------- |
��ʵ���Ŀ����_______________________________________________________________
________________________________________________��
����V1=___________mL.
��2�����淴ӦC(s)+H2O(g)  H2(g)+CO(g)����H>0�ﵽƽ��ı�ijһ������������ı����ʵ����������£�����Ӧ����
H2(g)+CO(g)����H>0�ﵽƽ��ı�ijһ������������ı����ʵ����������£�����Ӧ���� ��ʱ��t�Ĺ�ϵ����ͼ��
��ʱ��t�Ĺ�ϵ����ͼ��
��ͼ��t4��t6��ʱ����ƽ���ƶ������������� ��
��ͼ�б�ʾƽ��������CO�ĺ�����ߵ�һ��ʱ���� ��
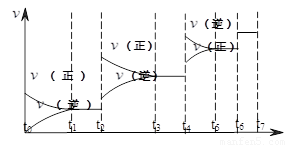
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com