
甲、乙、丙、丁分别是氢氧化钙溶液、硝酸钾溶液、碳酸钠溶液、盐酸中的一种。已知甲和丙可以反应,甲和丁也可以反应,则下列说法正确的是
A.甲一定是氢氧化钙溶液 B.乙一定是硝酸钾溶液
C.丙不可能是碳酸钠溶液 D.丁只能是盐酸
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
单晶硅是制作电子集成电路的基础材料。一个电脑芯片上如果集成10亿个晶体管, 其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化
其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化 学方法可制得高纯度硅,其化学方程式为:①SiO2 + 2C
学方法可制得高纯度硅,其化学方程式为:①SiO2 + 2C  Si + 2CO;②Si + 2Cl2
Si + 2CO;②Si + 2Cl2  SiCl4;③SiCl4 +2H2
SiCl4;③SiCl4 +2H2  Si + 4HCl,其中,反应①和③属于
Si + 4HCl,其中,反应①和③属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由KClO3变成KCl必须加入还原剂 | |
| B. | 向醋酸溶液中加入少量氢氧化钠溶液,因发生中和反应,溶液的导电能力降低 | |
| C. | 已知氨水的密度比水小,且浓度越大密度越小.则质量分数分别为5%和15%的氨水等体积混合,得到的溶液的质量分数大于10% | |
| D. | 一定条件下,H2与O2的混合气体对氮气的相对密度为1,则H2与O2的物质的量之比为2:13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2>2 Q1 | B. | Q1=92.4 kJ | C. | Q1<Q2<184.8 kJ | D. | Q1=Q2<92.4 kJ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
能用2H++ CO32- = H2O + CO2↑表示的是
A.CH3COOH和Na2CO3的反应 B.H2SO4和碳酸氢钠的反应
C.K2CO3和NaHSO4反应 D.碳酸钙和稀盐酸的反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:实验题
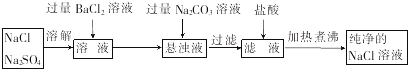
粗盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯;② 固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热。其正确的操作顺序为________________。
(2)该实验中加入除杂质试剂的顺序不正确的是_____________
A.NaOH BaCl2 Na2CO3
B.BaCl2 Na2CO3、 NaOH
C.BaCl2 NaOH Na2CO3
D.Na2CO3、 NaOH BaCl2
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:____________________________________;
过滤时:____________________________________;
蒸发时:____________________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
下列实验操作中错误的是
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 蒸发结晶时应将溶液蒸干
C. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
D. 称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液,滴加适量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 |
| 若无白色沉淀 | 滤液中无Ca(OH)2 | |
| 另取少量滤液,滴入适量盐酸 | 若出现气泡 | 滤液中含Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com