
| A、得到澄清透明的溶液 |
| B、所得溶液的pH为7 |
| C、取少量所得溶液,加KHCO3,无明显现象发生 |
| D、另取少量所得溶液,加入几滴KOH溶液,有白色沉淀 |
| 2.7g |
| 27g/mol |
| 3 |
| 2 |
| 2.7g |
| 27g/mol |
| 3 |
| 2 |


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL 冰醋酸混合,分别进行制取乙酸乙酯的研究.
某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL 冰醋酸混合,分别进行制取乙酸乙酯的研究.| 组 序 号 | 催化剂 | 反应现象 | C中饱和碳 酸钠溶液中 酯层高度 |
| ① | 2mL 98% 浓硫酸 | 20秒时溶液出现棕色,随反应进行,溶液颜色逐步加深,最后成黑色;酯层无气泡 | 2.10cm |
| ② | 2mL 14mol?L-1 硫酸 | 反应后溶液呈浅棕色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 | 2.14cm |
| ③ | 2mL 10mol?L-1 硫酸 | 反应后溶液呈无色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 | 2.16cm |
| ④ | 2mL 7mol?L-1 硫酸 | 反应后溶液呈无色;酯层与饱和碳酸钠界面有气泡 | 2.00cm |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 0 | 2 | 4 | 6 | 8 | … | 16 | 18 |
| n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | … | … | 1.000 | 1.000 |
| A、4~6min时间段内Z的平均反应速率为2.5×10-3mol/(L?min) | ||
| B、此温度下该反应的平衡常数K=1.44 | ||
C、达平衡后,升高温度,
| ||
| D、若保持其他条件不变,再充入1.6mol Z,达新平衡后Z的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、烧杯间填满碎泡沫塑料是减少实验过程中的热量损失 |
| B、使用环形玻璃棒既可以搅拌又避免损坏温度计 |
| C、向盛装酸的烧杯中加碱时要小心缓慢 |
| D、测定酸后的温度计要用蒸馏水清洗干燥后再测碱的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,②
,② ,③
,③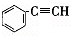 ,④CH3-CH=CH-CN,其中可用于合成
,④CH3-CH=CH-CN,其中可用于合成 结构简式为的高分子材料的正确组合为( )
结构简式为的高分子材料的正确组合为( )| A、①③④ | B、①②③ |
| C、①②④ | D、②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com