
| A. | 氯化铁溶液呈酸性,可用氯化铁溶液蚀刻铜电路板 | |
| B. | 铝的金属性比钒强,可用铝与五氧化二钒反应制取金属钒 | |
| C. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 | |
| D. | 二氧化硫具有漂白性,能使溴水褪色 |
分析 A.铁离子能与Cu发生氧化还原反应;
B.金属性强的金属可以金属性弱的金属还原出来;
C.双氧水分解时,二氧化锰作催化剂;
D.二氧化硫能被单质溴氧化.
解答 解:A.铁离子能与Cu发生氧化还原反应,利用了铁离子的氧化性,故A错误;
B.金属性强的金属可以金属性弱的金属还原出来,铝的金属性大于钒,可用铝与五氧化二钒反应制取金属钒,故B正确;
C.双氧水分解时,只有双氧水中O元素的化合价发生变化,二氧化锰中没有元素化合价的变化,二氧化锰不是氧化剂,作催化剂,故C错误;
D.二氧化硫能被单质溴氧化,二氧化硫能使溴水褪色,是因为二氧化硫具有还原性,故D错误.
故选B.
点评 本题考查了物质的性质及用途,明确物质的性质决定其用途是解本题关键,难度不大,侧重于考查学生的分析能力和应用能力.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 化合反应均为氧化还原反应 | |
| B. | 碱性氧化物一定是金属氧化物 | |
| C. | 同温同压下,相同体积的物质,其物质的量必然相等 | |
| D. | 摩尔是七个基本物理量之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | “吹出”采用热空气而不是常温空气的原因是热空气氧化性强 | |
| B. | 碱液吸收所发生的化学反应中氧化剂与还原剂之比为1:5 | |
| C. | 第③步中“酸化”要用强氧化性的酸,如硝酸 | |
| D. | 含溴的水溶液B中的单质溴浓度比A中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
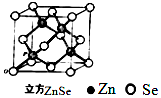 硒化锌是一种透明色半导体,也可作为红光外学材料,熔点1520℃.
硒化锌是一种透明色半导体,也可作为红光外学材料,熔点1520℃.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
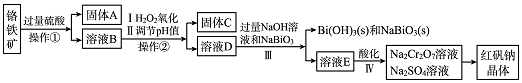
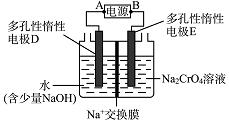
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将KI和H2O2溶液在试管中混合后,加入苯萃取,振荡,静置 | 上层溶液呈紫红色 | 氧化性:H2O2>I2 |
| B | 将刚刚用砂纸打磨过的铝箔放在酒精灯上加热 | 铝箔熔化,但不滴落 | 铝易被氧化;铝的熔点比氧化铝低 |
| C | 常温下,用pH试纸测量某浓度的NaHSO3溶液的pH | pH约为5.5 | 该溶液中的HSO3-的电离程度大于它的水解程度 |
| D | 向盛Mg(OH)2悬浊液的试管中加入适量NH4Cl浓溶液 | 溶液变澄清 | Mg(OH)2与NH4Cl溶液发生氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 | |
| C. | 用加热的方法可以除去KCl溶液中的Fe3+ | |
| D. | 锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com