
����Ŀ����������Ҫ������ȼ�Ϻͻ���ԭ�ϡ��ش��������⣺
(1)��֪![]() ��
��![]() ��
��![]() ��ȼ���ȷֱ�Ϊ
��ȼ���ȷֱ�Ϊ![]() ��
��![]() ,
,![]() �����ü����Ʊ��ϳ����ķ�ӦΪ
�����ü����Ʊ��ϳ����ķ�ӦΪ![]()
![]() ��
��
�������������ܷ����![]() ________(����������������)��������________________��
________(����������������)��������________________��
(2)��ij�ܱ�������ͨ��![]()
![]() ��
��![]() ���ڲ�ͬ�����·�����Ӧ��
���ڲ�ͬ�����·�����Ӧ��
![]()
![]()
���ƽ��ʱ![]() ������������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
������������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
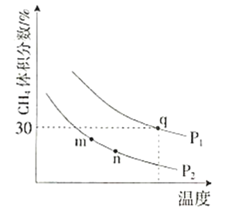
��![]() ________
________![]() ��
��![]() ________(����<������>������=��)��
________(����<������>������=��)��
��m��n��q����Ļ�ѧƽ�ⳣ����С��ϵΪ________��
��q������ת����Ϊ________���������µĻ�ѧƽ�ⳣ��![]() ________(�ú���
________(�ú���![]() �ı���ʽ��ʾ��
�ı���ʽ��ʾ��![]() Ϊ�Է�ѹ��ʾ��ƽ�ⳣ��)��
Ϊ�Է�ѹ��ʾ��ƽ�ⳣ��)��
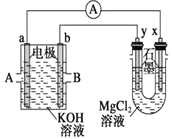
(3)�ü����![]() ���ɵ�ȼ�ϵ�ص��
���ɵ�ȼ�ϵ�ص��![]() ��Һ��װ������ͼ��ʾ����Ӧ��ʼ�۲쵽x�缫�������ְ�ɫ��������A��ͨ���������
��Һ��װ������ͼ��ʾ����Ӧ��ʼ�۲쵽x�缫�������ְ�ɫ��������A��ͨ���������
���𰸡��� ȱ��![]()
![]() > >0
> >0 ![]() 25%
25% ![]()
![]()
![]()
��������
��1��ȼ������ָ1mol��������ȫȼ�������ȶ���������ʱ���ͷŵ�������
��2������![]() ��֪���÷�ӦΪ��Ӧǰ������������ı�ķ�Ӧ��ѹǿ����ƽ�������ƶ���
��֪���÷�ӦΪ��Ӧǰ������������ı�ķ�Ӧ��ѹǿ����ƽ�������ƶ���![]() ���������������ͼ�еĺ����������������ɵã������¶ȵ����ߣ�
���������������ͼ�еĺ����������������ɵã������¶ȵ����ߣ�![]() �����������С�����¶����ߣ�ƽ�������ƶ���
�����������С�����¶����ߣ�ƽ�������ƶ���
�ڻ�ѧƽ�ⳣ��ֻ���¶��йأ��÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶����ߣ���ѧƽ�ⳣ������
��q��![]() ���������Ϊ
���������Ϊ![]() ����ʼͨ��
����ʼͨ��![]()
![]() ��
��![]() ����������ʽ��
����������ʽ��
![]()
ʼ̬![]()
ת��![]()
q��![]()
���㼴�ɣ�
��3����Ӧ��ʼ�۲쵽x�缫�������ְ�ɫ������˵��x�缫�����������������ӣ���x�������������ӷŵ�����������y�������������ӷŵ�����������x��ԭ��صĸ���������y��ԭ��ص�������������a�Ǹ�����b���������ݴ˷������
��1��ȼ������ָ1mol��������ȫȼ�������ȶ���������ʱ���ͷŵ��������ɷ�Ӧ![]() ��֪��ˮΪ��̬�����Բ�����
��֪��ˮΪ��̬�����Բ�����![]() ��
��![]() ��
��![]() ��ȼ���ȼ�����÷�Ӧ��
��ȼ���ȼ�����÷�Ӧ��![]() ��ȱ��
��ȱ��![]()
![]() ���ʴ�Ϊ����ȱ��
���ʴ�Ϊ����ȱ��![]()
![]() ��
��
��2������![]() ��֪���÷�ӦΪ��Ӧǰ������������ı�ķ�Ӧ��ѹǿ����ƽ�������ƶ���
��֪���÷�ӦΪ��Ӧǰ������������ı�ķ�Ӧ��ѹǿ����ƽ�������ƶ���![]() �������������ͼ��P1ʱ��
�������������ͼ��P1ʱ��![]() �������������P2ʱ��
�������������P2ʱ��![]() ���������������P1> P2����ͼ�еĺ����������������ɵã������¶ȵ����ߣ�
���������������P1> P2����ͼ�еĺ����������������ɵã������¶ȵ����ߣ�![]() �����������С�����¶����ߣ�ƽ�������ƶ������Ը÷�Ӧ������ӦΪ���ȷ�Ӧ��
�����������С�����¶����ߣ�ƽ�������ƶ������Ը÷�Ӧ������ӦΪ���ȷ�Ӧ��![]() >0���ʴ�Ϊ��>��>0��
>0���ʴ�Ϊ��>��>0��
�ڻ�ѧƽ�ⳣ��ֻ���¶��йأ��÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶����ߣ���ѧƽ�ⳣ�������¶ȴ�С��ϵΪ��![]() ������m��n��q����Ļ�ѧƽ�ⳣ����С��ϵΪ��
������m��n��q����Ļ�ѧƽ�ⳣ����С��ϵΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��q��![]() ���������Ϊ
���������Ϊ![]() ����ʼͨ��
����ʼͨ��![]()
![]() ��
��![]() ����������ʽ��
����������ʽ��
![]()
ʼ̬![]()
ת��![]()
q��![]()
��![]() ������q������ת����Ϊ��
������q������ת����Ϊ��![]() ���������µĻ�ѧƽ�ⳣ��
���������µĻ�ѧƽ�ⳣ�� ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��
��3����Ӧ��ʼ�۲쵽x�缫�������ְ�ɫ��������������������þ�İ�ɫ��������ӦʽΪ��![]() ����x�缫Ϊ������aΪ�����������
����x�缫Ϊ������aΪ�����������![]() ���ɵ�ȼ�ϵ���У�����������������������������A��ͨ���������
���ɵ�ȼ�ϵ���У�����������������������������A��ͨ���������![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��


 ���������ν�ϵ�д�
���������ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��CΪ��ѧ�������ʣ�����һ��Ϊ������ͨ������£�AΪ���壬BΪ�ӷ�Һ�壬CΪ���塣
D��E��F��G��X��Ϊ���������X��һ������ǿ�ᡢEΪ��ɫ���壬H�ڳ�����ΪҺ��.����֮���ת����ϵ��ͼ��ʾ������ijЩ��Ӧ�����Ͳ��ַ�Ӧ������ȥ����
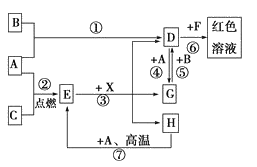
��1��д����ѧʽ��A___��D___��E___��X___��
��2���ڷ�Ӧ�١����У�������������ԭ��Ӧ����____�������ţ�
��3����Ӧ�����ӷ���ʽΪ____��
��4����Ӧ�ߵĻ�ѧ����ʽΪ____��
��5���÷�Ӧ��ÿ����0.3mol��A����ת�Ƶ���___mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���á�˫���š��������ת�Ƶķ������Ŀ�����ֱ�ָ�� ���������������
��1��Fe+CuSO4=FeSO4+Cu ________ �������� ____________����������_____________��
��2��3CO+Fe2O3![]() 3CO2+2Fe ________ �������� ____________����������_____________��
3CO2+2Fe ________ �������� ____________����������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���ۺ����ÿ����Ʊ�����þ������������ͼ��ʾ��
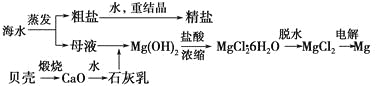
(1)Mg(OH)2�����л��е�Ca(OH)2Ӧ������ȥ��д��ʵ�鲽�衣__________________________
(2)ʵ���ҽ������Ƴɾ��εĹ����У��ܽ⡢���ˡ�������������IJ�����Ҫ�õ����������ֱ�˵���������������ʹ�ò�������Ŀ�ģ�
���ܽ⣺________________��
�ڹ��ˣ�__________________________��
��������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵؿ��к�����21�ḻԪ�أ�������������Ԫ�أ����������Ͱ�֢��������Ѫ�ܵȾ���DZ�ڵ�ҩ��ѧ���á���ҵ���ú����۷�![]() Ϊ����ijʯúΪԭ��(����
Ϊ����ijʯúΪԭ��(����![]() ��CaO������)���ƻ��������Ʊ�
��CaO������)���ƻ��������Ʊ�![]() �����������£�
�����������£�
![]()
��֪��+5�۷�����Һ�е���Ҫ������ʽ����ҺpH�Ĺ�ϵ���±���
pH | 4~6 | 6~8 | 8~10 | 10~12 |
��Ҫ���� |
|
|
|
|
(1)���գ���ʯú�м���ʯ�ұ��գ���![]() ת��Ϊ
ת��Ϊ![]() �Ļ�ѧ����ʽ��________________��
�Ļ�ѧ����ʽ��________________��
(2)�����![]() ������ˮ�����������ᡣ����ɰ���ʱ��Һ��
������ˮ�����������ᡣ����ɰ���ʱ��Һ��![]() ��
��![]() ������������ӷ���ʽ��________________��
������������ӷ���ʽ��________________��
(3)ת����������Һ�еķ�ת��Ϊ![]() ���壬���������£�
���壬���������£�
![]()
�ٽ���Һ�м���ʯ�����������____________________________________��
����![]() ��Һ�м���
��Һ�м���![]() ��Һ��������Һ��
��Һ��������Һ��![]() ����
����![]() ʱ��
ʱ��![]() �IJ������Խ��ͣ�ԭ����_______________________________________��
�IJ������Խ��ͣ�ԭ����_______________________________________��
(4)ʵ������![]() Ϊԭ�ϻ����Ժϳ������Ʊ�
Ϊԭ�ϻ����Ժϳ������Ʊ�![]() ������(IV)��ʽ̼��茶��壬�������£�
������(IV)��ʽ̼��茶��壬�������£�
![]()
�ٲ�����������ͼװ��(����������)�н��С���֪��![]() �ܱ�
�ܱ�![]() ������
������
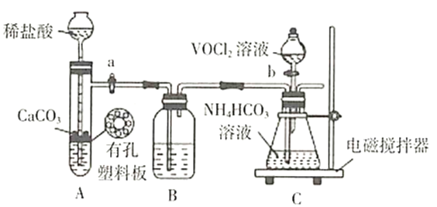
ҩƷ��װ��ɺ��ʵ�������________(��������a����������b���IJ���˳��)��װ��B�е��Լ���________��
�ڲⶨ����(IV)��ʽ̼��茶���ֲ�Ʒ�з��ĺ�����
����4.246g��Ʒ����ƿ�У���20mL����ˮ��30mL�������ܽ��![]() ��
��![]() ��Һ���Թ�������ַ�Ӧ�������1%
��Һ���Թ�������ַ�Ӧ�������1%![]() ��Һ���Թ������������س�ȥ������
��Һ���Թ������������س�ȥ������![]() �������
�������![]() ��
��![]() ����Һ�ζ����յ㣬�������Ϊ30.00mL(�ζ���Ӧ��
����Һ�ζ����յ㣬�������Ϊ30.00mL(�ζ���Ӧ��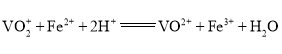 )��
)��
![]() ��Һ��������________________���ֲ�Ʒ�з�����������Ϊ________________(��ȷ��С�������λ)��
��Һ��������________________���ֲ�Ʒ�з�����������Ϊ________________(��ȷ��С�������λ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����2H2O(g)===2H2(g)��O2(g)����H����483.6 kJ��mol��1 ��H2S(g)===H2(g)��S(g)����H����20.1 kJ��mol��1�����ж���ȷ����(����)
A. ������ȼ���ȣ���H����241.8 kJ��mol��1
B. ��ͬ�����£����ȼ��1 mol H2(g)��1 mol S(g)�Ļ����ȳ��ȼ��1 mol H2S(g)���ȶ�20.1 kJ
C. �ɢ٢�֪��ˮ�����ȶ���С������
D. ���������ɹ�̬����H������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����(����)
A. ����Ͷ��NaOH��Һ�У�2Al��2OH��===2AlO2-��H2��
B. Na��CuSO4��Һ��Ӧ��Cu2����2Na===2Na����Cu
C. ��AlCl3��Һ�м��������İ�ˮ��Al3����3OH��===Al(OH)3��
D. Ba(OH)2��Һ��ϡ���ᷴӦ��Ba2����2OH����2H����SO42-===BaSO4����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ����ʵ���ж������������������£���������ǿ������˳����
����![]() ��Һ�еμ�
��Һ�еμ�![]() ��Һ���ټ���
��Һ���ټ���![]() ��
��![]() �����ɫ
�����ɫ
����![]() ��Һ�м�����ˮ���ټ���
��Һ�м�����ˮ���ټ���![]() ��Һ���ʺ�ɫ
��Һ���ʺ�ɫ
����![]() ��Һ�м���Ũ���ᣬ����ɫ��ȥ
��Һ�м���Ũ���ᣬ����ɫ��ȥ
A.![]() B.
B.![]()
C.![]() D.
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϊ��������ѧ���������ǿ�����ѧ����֪ʶ����������е�һЩ���⣬������ѧϰ����ҪĿ��֮һ������ij��ѧʵ����ȤС�飬һ�����ˣ�����ʵ������ʦ�ṩ�Ļ���������ҩƷ�����й����˼�����ʳ��������Ʒ������������̽����
I.��ͬѧ�ϼ������У��Զ�ʱ�ڼ���Ʒ�����������ϳ´���ζ�������£����游ĸ�����ɶ������Ǿ��ó����Ĵײ����ʱ��ζ��������������Ϻ�֪��ͼ1��Ϣ��
�ٴ����֣���������ƴף����ڵ��ϳ´ױ��뾭����ʱ������ŵô���ζ���г��϶����Ź�ҵ�����ˮ���ҵ����ƴף�
��������ұ�Ϊ���Ậ���������3.50g/100mL�������ƴ��ұ���Ϊ1.50g��3.50g/100mL��
������ʦ�İ����£��ⶨ�˳��й����ʳ���У���������ʵ���Ũ��Ϊ0.75mol/L��
��1���������ͬѧ����ӳ��й����ʳ���д��Ậ��Ϊ_____g/100mL������_____�ף�����������������������������ʾ������Ħ������Ϊ60g/mol��
��2����д�������뼦���ǣ���Ҫ�ɷ�ΪCaCO3����Ӧ�����ӷ���ʽ_____��
II.��ͼ1�dz��⻯ѧʵ����Ũ�����Լ���ǩ�ϵIJ������ݣ���ͬѧ���ø�Ũ��������100mL 1molL��1��ϡ���ᣮ�ɹ�ѡ�õ������У��ٽ�ͷ�ιܣ�����ƿ�����ձ�����ҩ�ף�����Ͳ����������ƽ���߲���������ش��������⣺
��1������ϡ����ʱ����ȱ�ٵ�������_____��
��2�������㣬����100mL1molL��1��ϡ������Ҫ����Ͳ��ȡ����Ũ��������Ϊ_____mL������С�����һλ����
��3���������Ƶ�ϡ������вⶨ��������Ũ��С��1molL��1����������ԭ�������_____��
A������ʱ��������ƿ�̶���
B������ƿ��ʹ��ǰδ�����������������ˮ
C��ת����Һ��δϴ���ձ��Ͳ�����
D������ҡ�Ⱥ���Һ���������ƿ�Ŀ̶��ߣ��ټ�ˮ���̶���
III.��ͬѧ�Կ�����ѧ���Ľ�������֪ʶ������Ũ����Ȥ��
��1�������������ļ����ĵ������Ƴ���Һ���ü����������Һ������һ������������������Һ���������Ϊ_____��
��2��������ͬѧ���ƺõ�������Һ���뵽��������Һ�У����ֳ�����״�������������Ϊ_____��
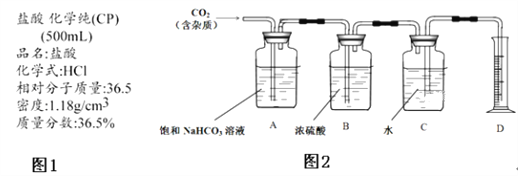
IV.��ͬѧ��ͼ�ⶨCO2����Է���������
�����ñ�ͬѧ�����ʣ�µļ����Ǻ���ͬѧ���ƺõ�ϡ������Һ�Ʊ�CO2��
�ڲ�ѯ����鼮���������ͼ2��ʾװ�ã�
��1������ͬѧ��ΪBװ���ڴ˴�û��Ҫ�������ԭ��_____��
��2��Aװ���еı���NaHCO3��Һ��������_____��
��3��ʵ��ǰ���Cװ�ã���ˮ������Ϊ50.00g��ʵ����Ϻ�Cװ�ã���ˮ������Ϊ40.02g��D����Ͳ����Ϊ10.0mL����֪H2�ܶ�Ϊ0.09g/L���������ݾ����ۺ�Ϊ�������ֵ����������������ݣ�����CO2����Է�������Ϊ_____������С�����һλ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com