
| A. | 随着原子序数的增大,元素的主要化合价逐渐增加 | |
| B. | 随着随着相对原子质量的增大,元素的化学性质会不断重复 | |
| C. | 与碱金属相比,其相邻主族的(碱土)金属具有更小的密度和硬度 | |
| D. | 卤素氢化物的稳定性随着核电荷数的增加而减弱 |
分析 A.同主族随着原子序数的增大,主要化合价相同;
B.元素的化学性质与相对原子质量无关;
C.金属的电荷越高、离子半径越小,密度与硬度越大;
D.卤素从上到下非金属性减弱,非金属性越强、对应氢化物越稳定.
解答 解:A.同主族随着原子序数的增大,主要化合价相同,而同周期随着原子序数的增大,元素的主要化合价逐渐增加(O、F除外),故A错误;
B.元素的化学性质与相对原子质量无关,随着随着相对原子质量的增大,不能判断元素的化学性质的变化,故B错误;
C.金属的电荷越高、离子半径越小,密度与硬度越大,则与碱金属相比,其相邻主族的(碱土)金属具有更大的密度和硬度,故C错误;
D.卤素从上到下非金属性减弱,非金属性越强、对应氢化物越稳定,则卤素氢化物的稳定性随着核电荷数的增加而减弱,故D正确;
故选D.
点评 本题考查元素周期表和周期律,为高频考点,把握元素在周期表的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | S Cl 的原子半径依次减小 | |
| B. | Na Mg 的失电子能力依次增强 | |
| C. | O F的气态氢化物的稳定性依次增强 | |
| D. | Si P 的最高价含氧酸的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
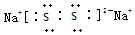 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D与E可形成既含极性键又含非极性键的分子 | |
| B. | B的最高价氧化物为酸性氧化物,不能与任何酸反应 | |
| C. | B、C、E三种元素的最高价氧化物对应的水化物中,B的酸性最弱 | |
| D. | A、C、D中两种或三种元素形成的钠盐溶液可显酸性、中性或碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
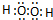 .
. ,用电子式表示A2C的形成过程.
,用电子式表示A2C的形成过程.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性、氢化物的沸点:W>Z | |
| B. | 原子半径:X>Y>W | |
| C. | X的氢化物、X2W溶于水后所得溶液都呈碱性 | |
| D. | Z的最高价氧化物常用作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
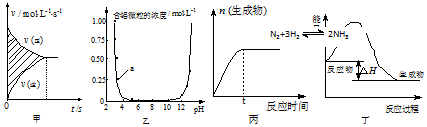
| A. | 图甲中阴影部分的面积表示v(正)与v (逆)的差值N2+3H2?2NH3 | |
| B. | 图乙表示溶液中含铝微粒浓度随pH变化曲线,a点所示溶液中存在大量AlO2- | |
| C. | 图丙表示一定条件下,该反应t时刻N2的转化率最大 | |
| D. | 图丁表示某吸热反应的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
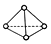 ,它是一种非极性分子.(填“极性”或“非极性”)
,它是一种非极性分子.(填“极性”或“非极性”)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com