
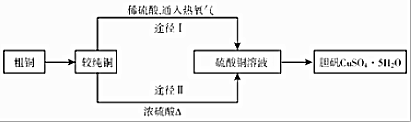
分析 (1)途径Ⅰ由铜与稀硫酸与氧气反应生成硫酸;途径Ⅱ由铜与浓硫酸加热反应生成硫酸铜和二氧化硫的反应;
(2)途径Ⅱ随着反应的进行,浓硫酸变稀,反应停止;利用稀硫酸与活泼金属生成氢气检验稀硫酸;
(3)途径Ⅱ有浓硫酸参加反应,消耗较多硫酸,并产生污染性二氧化硫气体.
解答 解:(1)途径Ⅰ由铜与稀硫酸与氧气反应生成硫酸,反应为:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;途径Ⅱ由铜与浓硫酸加热反应生成硫酸铜和二氧化硫,反应为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
故答案为:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)浓硫酸与铜发生反应Cu+2H2SO4(浓)Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O随着反应的进行,浓硫酸浓度逐渐降低,稀硫酸与铜不反应,则硫酸不能消耗完毕,稀硫酸与活泼金属反应生成氢气,可想溶液中加入足量的铁粉,H2SO4+Fe=FeSO4+H2↑,检验生成的气体即可;
故答案为:否;因随反应的进行,硫酸变稀,而稀H2SO4不与Cu反应,故H2SO4不会耗完;H2SO4+Fe=FeSO4+H2↑;
(3)比较反应的两个途径,途径Ⅱ有浓硫酸参加反应,消耗较多硫酸,并产生污染性二氧化硫气体;
故答案为:产生等量胆矾,途径I消耗硫酸少;途径I不产生污染大气的气体.
点评 考查实验准备方案设计与绿色化学等,难度中等,注意实验方案设计应理论正确、操作简单可行、经济节约、绿色环保.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
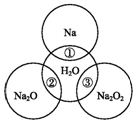 如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A. | 反应③最多能产生0.1 mol O2 | |
| B. | 反应①的离子方程式为Na+2H2O═Na++2OH-+H2↑ | |
| C. | Na2O2中阴阳离子数目之比为1:1 | |
| D. | ①②③充分反应后所得溶液中溶质的质量分数:②=③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾离子受到水分子的作用,克服了离子间的引力,逐渐向水中扩散 | |
| B. | 高锰酸根离子受到钾离子的作用,克服了离子间的斥力,逐渐向水中扩散 | |
| C. | 高锰酸根离子受到水分子的作用,克服了离子间的引力,逐渐向水中扩散 | |
| D. | 高锰酸钾是强氧化剂,水被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X+3Y?2Z | |
| C. | 改变温度可以改变此反应的平衡常数 | |
| D. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

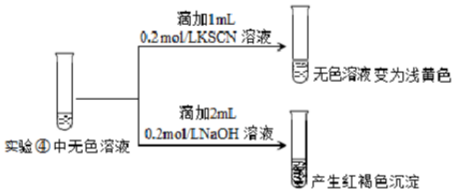
| 实验操作及现象 | ④向2mL0.2mol/L FeCl3溶液中滴入2mL1mol/LNaF溶液.溶液变无色 |
| ⑤向2mL0.2mol/L FeCl3溶液中滴入2mL蒸馏水,溶液颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
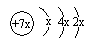 ,b与c形成的化合物的电子式为
,b与c形成的化合物的电子式为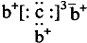 ,下列比较中正确的是( )
,下列比较中正确的是( )| A. | 原子半径:a>b>c | B. | 非金属性:a>c | ||
| C. | 氢化物的稳定性:c>a | D. | 最高价含氧酸的酸性:c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 目的 |
| A | 蒸馏 | 分离氯化钠和硝酸钾混合溶液 |
| B | 分液 | 分离乙酸与乙酸乙酯混合物 |
| C | 洗气 | 通入小苏打溶液中除去CO2中的HCl气体 |
| D | 用乙醇作萃取剂 | 提取溴水中的溴单质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
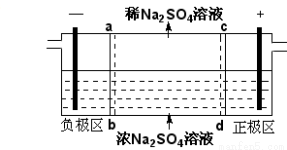
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com