
| A. | 5Cl2+I2+6H2O═10HCl+2HIO3 | |
| B. | 2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| C. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ | |
| D. | HCl+NaOH═NaCl+H2O |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 在自然界中以化合态的形式存在 | B. | 单质常用作半导体材料和光导纤维 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4在负极上反应;O2在正极上反应 | B. | 放电过程中电解质溶液的碱性减弱 | ||
| C. | 此电池属于环境友好电池 | D. | 此电池中化学能100%转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 热稳定性:HF<HCl<HBr<HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 熔点:Li<Na<K<Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多糖是很多个单糖分子按照一定的方式通过分子内脱水而结合成的 | |
| B. | 淀粉和纤维素都是重要的多糖,它们的通式都是(C6H10O5)n,二者互为同分异构体 | |
| C. | 多糖在性质上跟单糖、双糖不同,一般不溶于水,没有甜味,没有还原性 | |
| D. | 淀粉在稀H2SO4作用下水解最后生成葡萄糖和果糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜为正极,发生氧化反应 | B. | 锌为负极,被氧化 | ||
| C. | 用酒精替代稀硫酸电池会正常工作 | D. | 电池放电后,溶液变为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
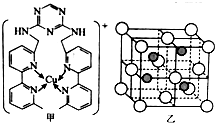 元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系.
元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系. 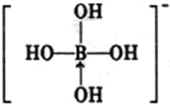 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8 mol | B. | 1.6 mol | C. | 0.4 mol | D. | 3.2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com