
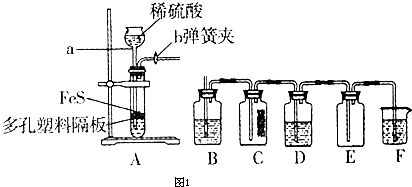

| 实验操作 | 实验现象 | |
| 实验l | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
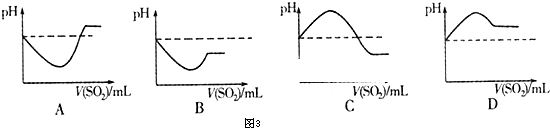


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、NaCl的电子式: |
B、CO2的分子模型示意图: |
C、CrO5的结构式为: 该氧化物中Cr为+6价 该氧化物中Cr为+6价 |
| D、次氯酸的结构式:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、转移电子4.8NA个 |
| B、生成气体的体积42.56L(标准状况) |
| C、还原剂比氧化剂多0.2mol |
| D、被还原的氮原子是8.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
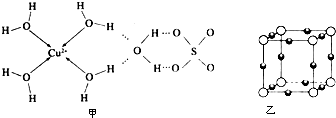
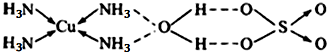
查看答案和解析>>
科目:高中化学 来源: 题型:
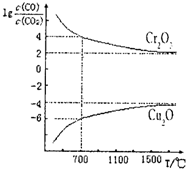 碳及其化合物有广泛用途.
碳及其化合物有广泛用途.| 7 |
| 2 |
| 1 |
| 2 |
| c(CO) |
| c(CO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com