
科目:高中化学 来源: 题型:
 水是组成生命体的重要化学物质,有关水的反应有很多.
水是组成生命体的重要化学物质,有关水的反应有很多.查看答案和解析>>
科目:高中化学 来源: 题型:
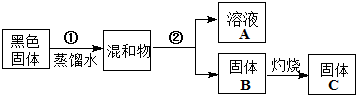
| 实验操作 | 预期现象 | 结论 |
| 步骤1:各取少量溶液A分装a、b、c三支试管,往a试管, | 有白色沉淀产生 | 说明溶液A含有Cl- |
| 步骤2:往b试管, | ||
| 步骤3:往c试管, | 先产生 后 | 说明溶液A含有Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅰ | 取一小段镁条,用砂纸擦去表面氧化膜,将其放入含有酚酞的饱和碳酸氢钠溶液中,过滤 | 产生大量气泡和白色不溶物,溶液有浅红色变成红色 | |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静的燃烧,产生淡蓝色火焰 | ①气体成分为 |
| 实验Ⅲ | 取实验Ⅰ中白色不溶物,洗涤,加入足量稀盐酸 | ② | 白色不溶物中含有 MgCO3 |
| 实验Ⅳ | ③ | 产生白色沉淀 | 溶液中存在CO32- |
| x |
| y |
查看答案和解析>>
科目:高中化学 来源: 题型:
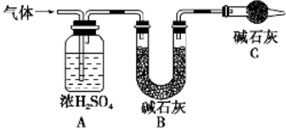
 某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.
某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.| A | B | C | D | |
| 应加试剂 | ||||
| 所除杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,下列叙述中不 正确的是( )
,下列叙述中不 正确的是( )| A、胡椒酚在核磁共振中氢光谱有6个波峰 |
| B、胡椒酚与溴水中Br2按1:2反应,可以生成3种有机物 |
| C、胡椒酚可与甲醛发生反应,生成聚合物 |
| D、胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
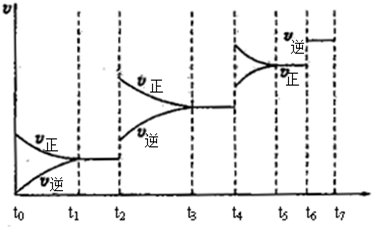
查看答案和解析>>
科目:高中化学 来源: 题型:

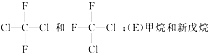
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2B的电离方程式为:H2B?2H++B2- |
| B、结合质子能力由强到弱的顺序为:B2->A->HB-C |
| C、等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强 |
| D、等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com