
【题目】下列说法不正确的是( )
A. 第IA族又叫碱金属元素,第VIIA族元素又叫卤族元素,0族元素又叫稀有气体元素
B. Ba(OH)2碱性比Ca(OH)2强
C. 元素周期表有7个主族,7个副族,1个0族,1个第Ⅷ族,共18纵行
D. X2+的核外电子数目为18,则X在第四周期第ⅡA族
科目:高中化学 来源: 题型:
【题目】化学反应N2+3H2===2NH3的能量变化如图所示,该反应的热化学方程式是( )
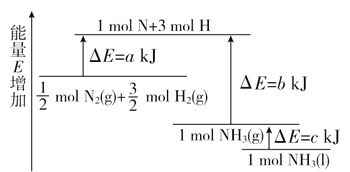
A. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(l) ΔH=(a-b-c) kJ/mol
H2(g)=NH3(l) ΔH=(a-b-c) kJ/mol
B. N2(g)+3H2(g)=2NH3(g) ΔH=2(b-a) kJ/mol
C. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(l) ΔH=(b+c-a) kJ/mol
H2(g)=NH3(l) ΔH=(b+c-a) kJ/mol
D. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) ΔH=(a+b) kJ/mol
H2(g)=NH3(g) ΔH=(a+b) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出相关的方程式:
(1)写出电解饱和食盐水的化学方程式
(2)氯化铵溶液呈现酸碱性的离子方程式
(3)乙醇和氧气以KOH为电解质的溶液形成的燃料电池的负极电极反应式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些资料表明:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析Na2O2和NO2都有氧化性,根据化合价升降原则提出如下假设:
假设Ⅰ. Na2O2氧化NO2; 假设Ⅱ. NO2氧化Na2O2。
请回答下列问题:
(1)甲同学设计如图1所示实验装置:
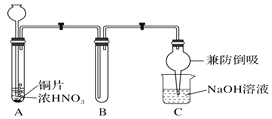
图1
①试管A中反应的离子方程式是___________________________________________________。
②待试管B中收集满气体,向试管B中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。甲同学据此认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,应在A、B之间增加一个装置,该装置的作用是__________________________________________________________________。
③乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的化学方程式是_____________________。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化,查阅资料知:
ⅰ) 2NO+Na2O2===2NaNO2;
ⅱ) 6NaNO2+3H2SO4===3Na2SO4+2HNO3+4NO↑+2H2O;
ⅲ)酸性条件下,NO或NO![]() 都能与MnO
都能与MnO![]() 反应生成NO
反应生成NO![]() 和Mn2+。
和Mn2+。
丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应:
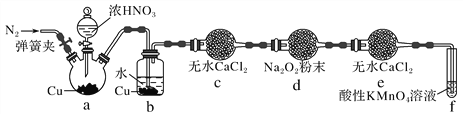
图2
①b装置中观察到的主要现象是__________________________________________________,f装置的作用是_________________________________________________________________。
②在反应前,先打开弹簧夹,通入一段时间N2,其目的是____________________________
③充分反应后,检验d装置中发生反应的实验是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体.但他在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体.
物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
[提出问题]为什么会生成淡黄色固体?
[查阅资料]该同学查阅资料,记录了右
表中几种物质的颜色:
(1)其他同学认为不必查阅氯化镁的颜色,理由是 ;
(2)[提出猜想]分析资料,A同学认为淡黄色固体可能是由镁与空气中的 反应生成的;
(3)[实验探究]该同学设计实验证实了自己的猜想,他的方案可能是 将点燃的镁条伸人充满氮气的集气瓶中,观察是否生成淡黄色的固体 ;
(4)[实验结论]根据该同学的实验结果,写出镁条在空气中燃烧时发生的两个反应的化学方程式: 、 ;
(5)[反思与评价]通过上述实验,你对燃烧有什么新的认识? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。
下列说法不正确的是( )
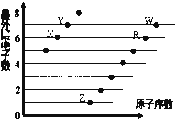
A. 氢化物沸点:H2X>HY>H2R B. 含氧酸酸性:HWO>H2RO4
C. 气态氢化物的稳定性:HY>HW>H2R D. 离子半径:R2->X2->Y->Z+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿(主要成分是Cu2S)是冶炼铜的主要原料,辉铜矿样品的纯度可以用酸性高锰酸钾溶液滴定来测定,该反应可表示为Cu2S+ ![]() +H+→Cu2++
+H+→Cu2++ ![]() +Mn2++H2O(未配平)。下列说法中不正确的是( )
+Mn2++H2O(未配平)。下列说法中不正确的是( )
A.Cu2S为还原剂被氧化, ![]() 为氧化剂被还原
为氧化剂被还原
B.氧化剂和还原剂物质的量之比为2∶1
C.反应中每消耗1 mol Cu2S,转移8 mol电子
D.滴定时可以不加其他的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 直径介于1 nm ~ 100 nm 之间的微粒称为胶体
B. 胶体粒子很小,可以透过半透膜
C. 利用丁达尔效应可以区别溶液和胶体
D. 向FeCl3溶液中加入NaOH溶液可制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大. I2在KI溶液中存在下列平衡:I2(aq)+I﹣(aq)I3﹣(aq).测得不同温度下该反应的平衡常数如图所示,下列说法正确的是( ) 
A.反应I2(aq)+I﹣(aq)I3﹣(aq)的△H>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com