
| A. | MgCl2溶液 | B. | FeCl3溶液 | C. | NaNO3溶液 | D. | K2SO4溶液 |
分析 硝酸银、盐酸、氢氧化钾三种溶液分别与FeCl3溶液反应的现象为:白色沉淀、无现象、红褐色沉淀,以此来解答.
解答 解:A.硝酸银、氢氧化钾均与MgCl2溶液反应生成白色沉淀,现象相同,不能鉴别,故A错误;
B.硝酸银、盐酸、氢氧化钾三种溶液分别与FeCl3溶液反应的现象为:白色沉淀、无现象、红褐色沉淀,现象不同,可鉴别,故B正确;
C.均不与硝酸钠反应,现象相同,不能鉴别,故C错误;
D.盐酸、氢氧化钾均不与硫酸钾反应,现象相同,不能鉴别,故D错误;
故选B.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、性质差异及发生的反应、反应现象为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A. | OA段所发生反应的离子方程式:H++OH-═H2O;CO32-+H+═HCO3- | |
| B. | NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 | |
| C. | 产生的CO2体积(标准状况下)为0.056L | |
| D. | 原NaOH溶液的物质的量浓度为0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CO2合成可降解塑料,实现碳的循环利用 | |
| B. | 提倡使用太阳能、潮汐能、风能等清洁能源,减少化石燃料的使用 | |
| C. | 提高煤炭和石油的产量,以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用,即减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
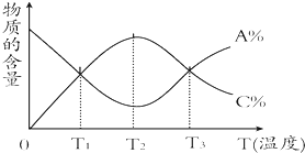
| A. | 该反应在T1、T3温度时达到化学平衡 | |
| B. | 该反应在T2温度时未达到化学平衡 | |
| C. | 升高温度,平衡会向正反应方向移动 | |
| D. | 该反应的正反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态氧、干冰、硫酸、烧碱、氯化钠 | B. | 碘酒、冰、盐酸、烧碱、食盐 | ||
| C. | 氢气、二氧化硫、硝酸、纯碱、硝酸钾 | D. | 铜、硫酸钠、醋酸、石灰水、氯化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a(A)>a′(A) a(B)<a′(B) | B. | a(A)>a′(A) a(B)=a′(B) | C. | a(A)<a′(A) a(B)<a′(B) | D. | a(A)=a′(A) a(B)>a′(B) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com