
【题目】天然气是重要的化石能源,其综合利用的研究意义重大。
已知;i.CH4(g)十H2O(g)![]() CO(g)+3H2(g) H=+206kJmol-1;
CO(g)+3H2(g) H=+206kJmol-1;
ii.CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) H=+165kJmol-1;
CO2(g)+4H2(g) H=+165kJmol-1;
iii.C(s)十H2O(g)![]() CO(g)十H2(g) H=+131.4kJmol-1。
CO(g)十H2(g) H=+131.4kJmol-1。
请回答下列问题:
(1)若将物质的量之比为1:1的CH4(g)和H2O(g)充入密闭容器中发生反应i。CH4(g)和CO(g)的平衡体积分数(φ)与温度(T)的关系如图所示:
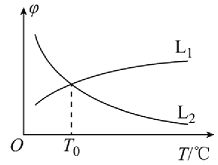
图中表示CH4(g)的平衡体积分数与温度关系的曲线为___(填“L1”或“L2”),原因为__。
(2)合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
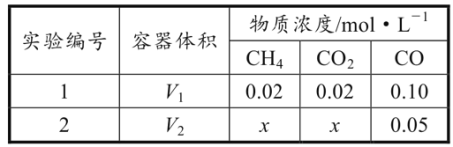
①H1=__。
②T℃下,该反应的平衡常数K=__。
③实验1中,CO的平衡体积分数为__%(保留三位有效数字)。
④V1:V2=_。
(3)甲烷在高温下分解生成的炭黑,是生成橡胶的重要原料,其分解原理为CH4(g)![]() C(s)+2H2(g)。
C(s)+2H2(g)。
①一定温度下,将n1molCH4充入1L恒容密闭容器中发生上述反应,tmin末容器内压强变为原来的1.6倍。tmin内该反应的平均反应速率v(H2)=__(用含n1和t的代数式表示)。
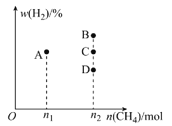
②若控制温度和压强不变,充入CH4的物质的量与平衡时H2的体积分数的关系如图所示。充入n1molCH4时,平衡点位于A点,则充入n2molCH4时,平衡点位于__(填“B”“C”或“D”)点。
【答案】L2 反应i为吸热反应,温度升高平衡正向进行甲烷体积分数降低; +247kJ/mol 0.25 41.7 3:7 ![]() mol/(Lmin) C
mol/(Lmin) C
【解析】
(1)反应i为吸热反应,图1中表示甲烷的平衡体积分数与温度关系的曲线为L2;
(2)①由盖斯定律计算H1
②T℃下,该反应的平衡常数K=![]() ,由图表数据计算得到;
,由图表数据计算得到;
③实验1中生成CO物质的量浓度=0.10mol/L,平衡状态下气体总浓度=0.02mol/L+0.02mol/L+0.1mol/L+0.1mol/L=0.24mol/L,据此计算CO的平衡体积分数;
④平衡常数随温度变化,利用平衡常数列式计算,![]() =0.25,x=0.005,假设平衡时的体积不变,将实验1和实验2中的平衡状态利用极值可以得到,当c(CO)=0mol/L时,实验1中c(CH4)=0.07mol/L,实验2中c(CH4)=0.03mol/L,而此时两个虚拟容器中甲烷的物质的量相同,物质的量浓度之比等于体积的反比;
=0.25,x=0.005,假设平衡时的体积不变,将实验1和实验2中的平衡状态利用极值可以得到,当c(CO)=0mol/L时,实验1中c(CH4)=0.07mol/L,实验2中c(CH4)=0.03mol/L,而此时两个虚拟容器中甲烷的物质的量相同,物质的量浓度之比等于体积的反比;
(3)①tmin②末容器内压强变为原来的1.6倍,气体物质的量变为原来的1.6倍为1.6n1mol,其中n(H2)=1.2n1mol,tmin内该反应的平均反应速率v(H2)=![]() ;
;
②若控制温度和压强不变,只改变甲烷的物质的量,平衡时氢气的体积分数不变。
(1)图1中表示甲烷的平衡体积分数与温度关系的曲线为L2,原因是反应i为吸热反应,温度升高平衡正向进行甲烷体积分数降低,故答案为:L2;反应i为吸热反应,温度升高平衡正向进行甲烷体积分数降低;
(2)①已知:i.CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206kJmol-1;
ii.CH4(g)+2H2O(g)CO2(g)+4H2(g)△H=+165kJmol-1;
盖斯定律计算i×2-ii得到:CH4(g)+CO2(g)2CO(g)+2H2(g)△H1=+247kJ/mol,故答案:+247kJ/mol;
②T℃下,该反应的平衡常数K=![]() =
=![]() =0.25,故答案为:0.25;
=0.25,故答案为:0.25;
③实验1中生成CO物质的量浓度=0.10mol/L,平衡状态下气体总浓度=0.02mol/L+0.02mol/L+0.1mol/L+0.1mol/L=0.24mol/L,CO的平衡体积分数=![]() ×100%=41.7%,故答案为:41.7;
×100%=41.7%,故答案为:41.7;
④利用平衡常数列式计算,![]() =0.25,x=0.005,假设平衡时的体积不变,将实验1和实验2中的平衡状态利用极值可以得到,当c(CO)=0mol/L时,实验1中c(CH4)=0.07mol/L,实验2中c(CH4)=0.03mol/L,而此时两个虚拟容器中甲烷的物质的量相同,则物质的量浓度之比等于体积反比,V1:V2=3:7,故答案为:3:7;
=0.25,x=0.005,假设平衡时的体积不变,将实验1和实验2中的平衡状态利用极值可以得到,当c(CO)=0mol/L时,实验1中c(CH4)=0.07mol/L,实验2中c(CH4)=0.03mol/L,而此时两个虚拟容器中甲烷的物质的量相同,则物质的量浓度之比等于体积反比,V1:V2=3:7,故答案为:3:7;
(3)①tmin②末容器内压强变为原来的1.6倍,气体物质的量变为原来的1.6倍为1.6n1mol,其中n(H2)=1.2n1mol,tmin内该反应的平均反应速率v(H2)=![]() mol/(Lmin),故答案为:
mol/(Lmin),故答案为:![]() mol/(Lmin);
mol/(Lmin);
②若控制温度和压强不变,只改变甲烷的物质的量,平衡时氢气的体积分数不变,平衡点在C点,故答案为:C。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】关于有机物的下列说法正确的是
A.苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色
B.等质量的乙烯和甲烷燃烧时,乙烯消耗氧气多
C.苯分子中的碳碳键为单键与双键交替存在
D.乙烯和乙烷可用溴水来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种反应类型:①消去 ②取代 ③水解 ④加成 ⑤还原 ⑥氧化,用丙醛制取1,2-丙二醇 ( ),按正确的合成路线依次发生的反应所属类型不可能是( )
),按正确的合成路线依次发生的反应所属类型不可能是( )
A. ⑤⑥③① B. ⑤①④③ C. ⑤①④② D. ④①④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷的催化裂解可按下列两种方式进行:C4H10→C2H6+C2H4; C4H10→CH4+C3H6;某化学兴趣小组的同学为探究丁烷裂解气中CH4和C2H6的比例关系,设计如图所示实验:
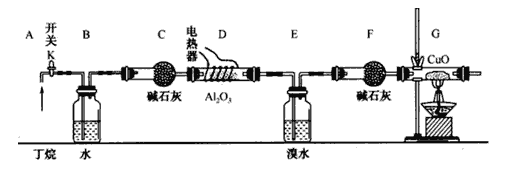
注:CuO能将烃氧化成CO2和H2O;A12O3是丁烷裂解的催化剂,G后面装置已省略。如图连接好装置后(部分夹持装置已略去),需进行的实验操作有:
①给D、G装置加热:②检査整套装置的气密性;③排尽装置中的空气。
(1)这三步操作的先后顺序依次是____________。
(2)简要说明检验空气排尽的方法:_______________________________________________。
(3)B装置所起的作用是__________________________________________。
(4)假设丁烷完全裂解,流经各装置中的气体能完全反应。当(E和F)装置的总质量比反应前增加了 1.82g, G装置中固体质量减少了 4.l6g,则丁烷的裂解产物中n(CH4)∶n(C2H6)=_____________。
(5)若对E装置中的混合物再按以下流程实验:

①分离操作I、Ⅱ的名称是I_____________、 II_______________;
②Na2SO3溶液的作用是(用离子方程式表示)__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷基取代苯![]() 可以被KMnO4的酸性溶液氧化生成
可以被KMnO4的酸性溶液氧化生成![]() ,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到
,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到![]() 。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为
。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为![]() 的异构体共有7种,其中的3种是
的异构体共有7种,其中的3种是![]() 、
、![]() 、
、![]() 。请写出其他4种的结构简式:_________________、________________、_________________、___________________。
。请写出其他4种的结构简式:_________________、________________、_________________、___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是一种抗心率失常药物中间体,实验室由化合物A、B制备M的一种合成路线如图所示:

已知:①R1COR2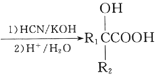 (R1、R2表示氢原子或烃基)
(R1、R2表示氢原子或烃基)
②![]() (-NH2易被氧化)
(-NH2易被氧化)
③RCOOH![]() RCOCl
RCOCl
请回答下列问题:
(1)A中官能团的名称为__,B的化学名称为__。
(2)C的结构简式为__。
(3)由B生成F的反应类型为__。
(4)由E与G反应生成H的化学方程式为___。
(5)反应I中加入的过量NH3,除作为反应物外,另一个作用为___。
(6)同时满足下列条件的M的同分异构体有___种(不考虑立体异构)。
①苯环上连有3个取代基,其中2个为-NH2
②能发生银镜反应
③核磁共振氢谱中有6组吸收峰
(7)参照上述合成路线和信息,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:__。
的合成路线:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钴酸锂电池的总反应方程式为Li1-xCoO2+LixC6=LiCoO2+6C。用该电池作电源按如图所示装置进行电解。通电后,电极a上一直有气泡产生,电极d附近先出现白色沉淀(CuCl),t min后白色沉淀全部转变成橙黄色沉淀(CuOH)。下列有关叙述不正确的是
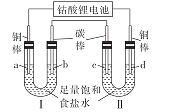
A.钴酸锂电池放电时的正极反应为Li1-xCoO2 +xe- +xLi+=LiCoO2
B.当电极a处产生标准状况下气体2. 24 L时。钴酸锂电池负极质量减少1.4g
C.电极d为阳极,电解开始时电极d的反应式为Cu+C1-- e- =CuCl
D.电解tmin后.装置II中电解质溶液的pH显著增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常量的值,最早由奥地利化学及物理学家JohannJosefLoschmidt测得,有时候用L代替NA表示阿伏伽德罗常量的值,下来说法错误的是
A.1.1g的11B中,含有0.6L个中子
B.pH=1的H3PO4溶液中,含有0.1L个H+
C.标准状态下的33.6L氯气与27g铝充分反应,转移电子数为3L
D.1L1mol/LNaCl溶液和1L1mol/LNaF溶液中离子总数:前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.

(1)甲池是 ______ 装置;
(2)乙池中A(石墨)电极的名称是 ______ ;
(3)写出通入CH3OH的电极的电极反应式: ______ ;
(4)乙池中反应的化学方程式为 ______ ;
(5)当乙池中B(Ag)极的质量增加4.32g时,甲池中理论上消耗O2 _____mL(标准状况);此时丙池某电极上析出1.60g某金属,则丙池中的某盐溶液可能是 ______ (填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com