
已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
已知:两种成键元素间电负性差值大于1.7时,形成离子键,两种成键元素间电负性差值小于1.7时,形成共价键。
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是_______________
________________________________________________________________________。
(2)判断下列物质是离子化合物还是共价化合物?
Mg3N2 BeCl2 AlCl3 SiC
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是原子序数依次增大的4种短周期元素(稀有气体除外)。其中只有X为金属元素,焰色反应为黄色。W、Y的原子最外层电子数相等,且W的原子最外层电子数是其内层电子数的3倍。请回答:
(1)W在元素周期表中的位置 。
(2)X单质与水反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表所列电离能I/kJ·mol-1的数据,下列判断中错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 800 | 2 700 | 11 600 |
A.元素X和Y可能是同周期元素
B.元素X不可能是ⅡA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.元素Y在化学性质上与锡相似
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中错误的是( )
A.原子半径 Na>Si>Cl
B.金属性 Na>Mg>Al
C.稳定性 SiH4<HCl<H2S
D.酸性 H3PO4<H2SO4<HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程属于“氮的固定”的是 ( )
A.氮气经加压、降温转变为液态氮
B.N2和O2经放电生成NO
C.NH3催化氧化生成NO和H2O
D.NH3被H2SO4吸收生成(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
对于某些离子的检验及结论一定正确的是( )
A 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有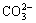
B 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有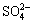
C 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有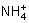
D 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组的同学想通过下图实验装置探究SO2与Na2O2反应的产物。(夹持装置已略去,装置的气密性良好)
Ⅰ.实验中装置B可吸收水分,干燥SO2气体,其目的是_____________________。
装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是:_____________。
Ⅱ.对C中固体产物提出如下假设:(假设Na2O2已全部反应)
假设1:__________。 假设2:只有Na2SO4; 假设3:既有Na2SO3又有Na2SO4。
(1)甲同学认为SO2与Na2O2的反应不同于CO2,应为假设2成立,请据此写出C中所发生反应的化学方程式:_____________________。
(2)若假设2成立,为确定C中固体产物的成分,甲同学设计如下实验:
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
②滴加过量的1mol•L-1Ba(NO3)2溶液,产生白色沉淀;
③滴加适量的1mol•L-1稀盐酸,白色沉淀不溶解;
得出结论:C中固体产物只有Na2SO4。该方案是否合理?答:__________。(填“是”
或“否”)理由是______________________________。
(3)乙同学为证明假设3成立,设计如下实验, 实验步骤和结论为:
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
②滴加过量的1mol•L-1BaCl2溶液,若产生白色沉淀,则证明C中固体产物中_________;
③滴加适量的1mol•L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,则证明C中固体产物中有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是一种线型高分子的一部分:
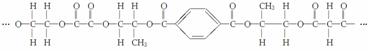
由此分析,这种高分子化合物的单体至少有______种,它们的结构简式为________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com