

分析 (1)①溴苯中的溴易挥发,非极性分子的溶质易溶于非极性分子的溶剂,据此分析苯的作用;该反应中有溴化氢生成,溴化氢溶于水得到氢溴酸,氢溴酸能使石蕊试液变红色;氢溴酸能和硝酸银反应生成淡黄色沉淀溴化银;
②溴苯是有机物,不溶于氢氧化钠溶于,且密度大于氢氧化钠溶液;
③装置D和E导管口在液面上方,能防止倒吸,倒置漏斗增大了气体与氢氧化钠溶液的接触面积,有缓冲作用,能够防止倒吸;
(2)①浓硫酸与浓硝酸混合放出大量的热,配制混酸应将浓硫酸中注入浓硝酸中,及时搅拌、冷却,防止溅出伤人;
②分离互不相溶的液态,采取分液操作,需要用分液漏斗;
③制备硝基苯时要用到硫酸、硝酸,可以用5% NaOH溶液洗涤.
解答 解:(1)①溴苯中的溴易挥发,溴和四氯化碳都是非极性分子,根据相似相溶原理知,溴易溶于四氯化碳,所以四氯化碳的作用是吸收溴蒸汽;该反应中有溴化氢生成,溴化氢溶于水得到氢溴酸,氢溴酸是酸性物质,能使石蕊试液变红色;氢溴酸能和硝酸银反应生成淡黄色沉淀溴化银,所以观察D和E两试管,看到的现象是D管中变红,E管中出现浅黄色沉淀,
故答案为:除去HBr气体中混有的溴蒸气;D管中变红,E管中出现浅黄色沉淀;
②溴苯是有机物,氢氧化钠溶液是无机物,所以溴苯和氢氧化钠溶液不互溶,且溴苯的密度大于水的密度,所以在B中的氢氧化钠溶液里可观察到的现象是底层出现油状液体,
故答案为:底层出现油状液体;
③装置D、E导管口在液面上方,能防止倒吸,F装置中倒置球形漏斗有缓冲作用,气体能充分被吸收且防止倒吸,
故答案为:DEF;
(2)①浓硫酸与浓硝酸混合放出大量的热,配制混酸操作注意事项是:将浓H2SO4沿器壁缓缓注入盛有浓HNO3的烧杯中,边注入边搅拌,
故答案为:将浓H2SO4沿器壁缓缓注入盛有浓HNO3的烧杯中,边注入边搅拌;
②硝基苯是油状液体,与水不互溶,分离互不相溶的液态,采取分液操作,需要用分液漏斗,
故答案为:分液漏斗;
③反应得到粗产品中有残留的硝酸及硫酸,用氢氧化钠溶液洗涤除去粗产品中残留的酸,
故答案为:除去反应体系中的混合酸.
点评 本题考查了制备方案的设计,题目难度中等,明确制备原理及实验目的为解答关键,注意掌握溴苯及硝基苯的制备方法,试题侧重考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
 2:1.
2:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钙的化学式是Ca2O2 | |
| B. | 1mol过氧化钠和过氧化钙的混合物中,阴影离子数个数比为1:2 | |
| C. | 过氧化钙与足量水反应生成0.5mol氧气时,转移的电子数为2NA | |
| D. | 过氧化钠和过氧化钙都可作漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
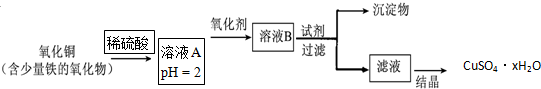

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2O>HF>H2S | |
| B. | NH4Cl的电子式: | |
| C. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| D. | 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
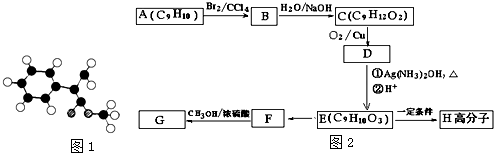
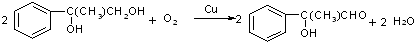 ;
;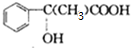 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com