
【题目】在200 mL氯化镁和氯化铝的混合液中,Mg2+的物质的量浓度为0.2 mol·L-1,Cl-的物质的量浓度为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需要加入4 mol·L-1 NaOH溶液的体积为 ( )
A.40 mL B.72 mL C.80 mL D.128 mL
【答案】C
【解析】
试题分析:溶液中存在2n(Mg2+)+3n(Al3+)=n(Cl-)=0.2L×1.3mol/L=0.26mol,因n(Mg2+)=0.2mol/L×0.2L=0.04mol,可知n(Al3+)=![]() ×(0.26mol-0.04mol×2)=0.06mol,欲使Mg2 + 全部沉淀分离出来,可发生Mg2 + + 2OH- = Mg(OH)2↓,Al3 + + 4OH- = AlO2- + 2H2O,Al3 + 应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,利用Na、Cl、Al原子守恒,有n(NaOH) = n(NaCl) + (NaAlO2) = n(Cl-) + n(Al3 + ) = 0.26mol + 0.06mol = 0.32mol,属于至少需要加入4mol/L NaOH溶液的体积
×(0.26mol-0.04mol×2)=0.06mol,欲使Mg2 + 全部沉淀分离出来,可发生Mg2 + + 2OH- = Mg(OH)2↓,Al3 + + 4OH- = AlO2- + 2H2O,Al3 + 应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,利用Na、Cl、Al原子守恒,有n(NaOH) = n(NaCl) + (NaAlO2) = n(Cl-) + n(Al3 + ) = 0.26mol + 0.06mol = 0.32mol,属于至少需要加入4mol/L NaOH溶液的体积![]() = 0.08L = 80mL,故选C。
= 0.08L = 80mL,故选C。


科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是
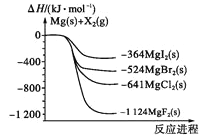
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2<MgBr2<MgCl2<MgF2
C.常温下氧化性:F2<Cl2<Br2<I2
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:
MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g),ΔH=-117kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是______________,基态铜原子的核外电子排布式为________________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____________(填晶体类型)。
(3)CO和CO的一种生活中常见等电子体分子,两者相比较沸点较高的为__________(填化学式)。CN-中碳原子杂化轨道类型为_______________,C、N、O三元素的第一电离能最大的为_______________(用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图1所示。每个铜原子周围距离最近的铜原子数目__________。
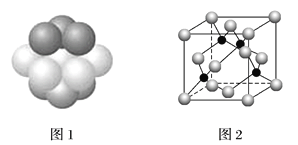
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(黑点代表铜原子)。
①该晶体的化学式为_____________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于________________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,已知该晶体中铜原子和M原子之间的最短距离为体对角线的1/4,则该晶体中铜原子和M原子之间的最短距离为_______________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何用所提供的试剂和方法除去各混合物粉末中的杂质(括号内为杂质)?将所选答案的编号填入表中相应的空格内。(如果不需补加试剂,则对应答案栏可空着)
可供选择的试剂:![]()
可供选择的操作:①分液 ②加热 ③高温灼烧 ④过滤 ⑤结晶
粉末状混合物 | 所加试剂 | 主要操作 | |
(1) | SiO2(CaCO3) | ||
(2) | CaCO3(SiO2) | ||
(3) | NaCl(SiO2) | ||
(4) | SiO2(Fe2O3) | ||
(5) | SiO2(H2SiO3) | ||
(6) | SiO2(Na2SO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学】
聚酯增塑剂广泛应用于耐油电缆、煤气管、防水卷材、电气胶带;耐油耐汽油的特殊制品等。聚酯增塑剂G及某医药中间体H的一种合成路线如下(部分反应条件略去):

已知:
 [来
[来
(1)A的名称(系统命名): ,H的分子式为 。
(2)写出下列反应的反应类型:反应①是 ,反应④是 。
(3)G的结构简式为 。
(4)写出反应②的化学方程式:② 。
(5)C存在多种同分异构体,写出核磁共振氢谱只有两种峰的同分异构体的结构简式 。
(6)利用以上合成路线的信息,以甲苯和乙醇为原料合成下面有机物(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )
![]()
A.x>y B.SO2是该反应的催化剂
C.MFe2Ox是还原剂 D.氧化性:MFe2Oy>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去物质中的杂质(括号内为杂质),选用试剂正确的是
物质 | 选用试刘 | |
A | NaBr溶液(NaI) | 溴水 |
B | CuCl2溶液(FeCl3) | 铜粉 |
C | 乙烷(乙烯) | 氢气 |
D | 溴苯(苯) | 液溴 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1) 需要量取质量分数为98%密度为1.84 g/mL的浓硫酸___________mL。
(2)量取浓硫酸时,用下面那种规格的量筒__________(填序号)
①10 ml ②50 ml ③100 ml ④500 ml
(3)配制该稀硫酸时使用的仪器除量筒、烧杯外,还必须用到的仪器有 、 、 等.
(4)在配制过程中,如果出现下列情况,将对所配溶液的物质的量浓度有何影响? (填“偏高”、“偏低”或“无影响”)
①容量瓶用蒸馏水洗涤后,没干燥 _____________。
②用量筒量取浓硫酸后,洗涤量筒2-3次并缓缓倒入烧杯中_____________。
③定容时,仰视观察容量瓶刻度线_____________。
④摇匀后发现液面低于刻度线,再补加水 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com