
| A. | SO42- | B. | NO3- | C. | SCN- | D. | CO32- |
科目:高中化学 来源: 题型:选择题
| A. | 氯气和二氧化硫都能使品红溶液褪色 | |
| B. | 异戊烷和异戊二烯都能使溴水层褪色 | |
| C. | 亚硫酸钠和乙烯都能使酸性高锰酸钾溶液褪色 | |
| D. | 活性炭与氢氧化钠溶液都能使二氧化氮气体褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
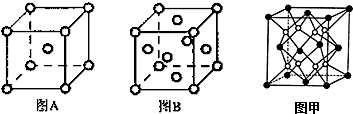 X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子; M 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子; M 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示): ,其基态原子有26种运动状态不同的电子;
,其基态原子有26种运动状态不同的电子;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
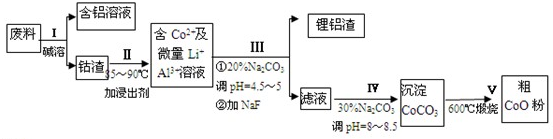
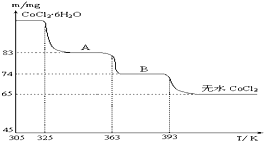
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L CO2中含有原子数为0.3NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-为0.1NA | |
| C. | 一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1NA | |
| D. | 1L0.1molL-1的氨水中有NA个NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3能与酸反应,但不能与碱反应 | |
| B. | FeO在空气中受热,会被氧化为Fe3O4 | |
| C. | Na2O2既有氧化性又有还原性,故Na2O2属于两性氧化物 | |
| D. | Na2O和Na2O2中阴、阳离子个数之比分别为1:2 和1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com