
��1��FeCl3��ˮ��Һ�� (���ᡱ�����С���������ԣ�����ʱ��pH 7���>������=������<������ԭ���ǣ������ӷ���ʽ��ʾ���� ��
(2)ʵ���������� FeCl3����Һʱ������FeCl3���������� �У�Ȼ����������ˮϡ�͵������Ũ�ȡ�
��3����FeCl3��Һ���ɣ����գ����õ�����Ҫ������ ��
��4����ͨ��ĭ������ڵIJ���Ͳ��ʢ��������Һ����Ͳ��ʢ̼��������Һ���仯ѧ��Ӧ��ԭ���ǣ������ӷ���ʽ���ͣ� ��̼��������Һ�еĵ���غ�ʽΪ ����Һ������Ũ���ɴ�С��˳��Ϊ ��
 ���ݼ���ϵ�д�
���ݼ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ�����ӵ�������ֵ�������й�������ȷ����
A��0.1mol NH3��������ˮ��(�����ǰ����ӷ�)����Һ��Nԭ�ӵ���ĿΪ0.1NA
B����״���£�22.4LNO��CO2�Ļ�������к���Oԭ����Ϊ3NA
C��0.1molN2��������H2��Ӧ��ת�Ƶĵ�������0.6NA
D��58.5 g��NaCl�����к���NA���Ȼ��Ʒ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й�ʵ��IJ�����������������ؽ�����ȷ����
A��ȡ������Һ���Ӽ���KSCN��Һ������Ѫ��ɫ������������Һ�к���Fe3+
B��Na2SO4��10H2Oʧˮʱ���ȣ��ᾧʱ���ȣ�����þ������Ϊ���Ȳ���ʵ�ֻ�ѧ�������ܵ��ת��
C��ȡ5mL0.1mol��L-1KI��Һ���μ�0.1mol��L-1FeCl3��Һ5-6�Σ���������2mLCCl4��������ã�ȡ�ϲ���Һ��KSCN��Һ������������
D��ȡһС������ƣ�����ֽ���ɱ����ú�ͣ������ձ��У��ټ�һ������ˮ���۲�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25 ��ʱ���ڵ�����Ģ�pH��0��H2SO4��Һ
��0.05 mol·L��1��Ba(OH)2��Һ����pH��10��Na2S��Һ����pH��5��NH4NO3��Һ�У����������ˮ�����ʵ���֮���� (����)
A��1��10��1010��109 B��1��5��5��109��5��108
C��1��20��1010��109 D��1��10��104��109
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£���ijһԪ��HA��NaOH��Һ�������ϣ�ʵ����Ϣ���£�
| ʵ���� | c(HA)/ mol·L��1 | c(NaOH)/ mol·L��1 | ��Ӧ����ҺpH |
| �� | 0.1 | 0.1 | pH��9 |
| �� | c1 | 0.2 | pH��7 |
�����жϲ���ȷ���� (����)
A��c1һ������0.2 mol·L��1
B��HA�ĵ��뷽��ʽ��HA H����A��
H����A��
C����Ӧ����Һ�У�c(Na��) > c(OH��) > c(A��) > c(H��)
D���ҷ�Ӧ����Һ�У�c(Na��) < c(HA)��c(A��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ݻ�Ϊ2L���ܱ������г���2molSO2��һ����O2��������Ӧ2SO2��O2  2SO3������Ӧ���е�4minʱ�����n(SO2)��0.6mol������Ӧ���е�2minʱ��������SO2�����ʵ�����
2SO3������Ӧ���е�4minʱ�����n(SO2)��0.6mol������Ӧ���е�2minʱ��������SO2�����ʵ�����
A������1.3mol B����1.3mol C������1.4mol D������1.4mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ѧ�����ö������棨CeO2����̫���������½�H2O��CO2ת���H2��CO����������£�
����˵������ȷ����

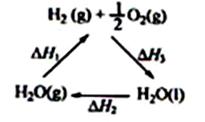
A���ù�����CeO2û������
B���ù���ʵ����̫������ѧ�ܵ�ת��
C����ͼ�С�H1=��H2+��H3
D��H2(g)+ 1/2 O2(g) = H2O(g)�ķ�Ӧ��С�ڡ�H3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵���У�����ȷ����(����)
A���о����ʵ�����ʱ�����õ��۲졢ʵ�顢���ࡢ�Ƚϵȷ���
B�����ա�ұ����Ƶ����������У��϶������˻�ѧ��Ӧ
C��1869�������ѧ���Ž��з������ԭ��ѧ˵��Ϊ������ѧ�ķ�չ�춨�˼�ʵ�Ļ���
D���ҹ���ѧ����1965���һ���˹��ϳ��˾����������Եĵ����ʣ�Ϊ����������ѧ���о��ͷ�չ�����˹���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com