
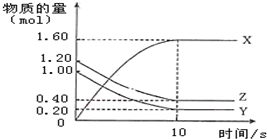
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.04 mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度增加了0.8 mol/L | |
| C. | 反应开始到10s时,Y的转化率为80.0% | |
| D. | 反应的化学方程式为:4Z(g)+5Y(g)═8X(g) |
分析 A.根据v=$\frac{\frac{△n}{V}}{△t}$计算出应开始到10s用Z表示的反应速率;
B.根据c=$\frac{n}{V}$计算出反应开始到10sX的物质的量浓度变化;
C.反应开始到10s时,Y的物质的量变化为:1.00mol-0.20mol=0.80mol,初始物质的量为1.20mol,据此计算出Y的转化率;
D.根据物质的量变化判断反应物、生成物,然后根据物质的量变化与化学计量数成正比得出该反应的化学方程式.
解答 解:A.应开始到10s用Z表示的反应速率为:v(Z)=$\frac{\frac{1.2mol-0.4mol}{2L}}{10s}$=0.04 mol/(L•s),故A正确;
B.反应开始到10s,X增大的物质的量浓度为Lc(X)=$\frac{1.6mol}{2L}$=0.8mol/L,故B正确;
C.反应开始到10s时,Y的转化率为:$\frac{1.00mol-0.20mol}{1.00mol}$×100%=80%,故C正确;
D.反应开始到10s时,X的物质的量增大了1.60mol,Y的物质的量减小了:1.00mol-0.20mol=0.80mol,Z的物质的量减小了:1.20mol-0.40mol=0.80mol,根据化学计量数与物质的量变化成正比可知该反应的方程式为:Z(g)+Y(g)?2X(g),故D错误;
故选D.
点评 本题考查了物质的量随时间变化的曲线,题目难度中等,涉及化学反应速率、转化率的计算、物质的量浓度的计算及化学方程式书写等知识,明确化学反应速率的表达式为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 接触法制备硫酸主要的设备有沸腾炉、合成塔和吸收塔 | |
| B. | 工业制备硫酸中,尾气二氧化硫使用NaOH溶液吸收的 | |
| C. | 工业制备硫酸中,三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使三氧化硫吸收完全 | |
| D. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
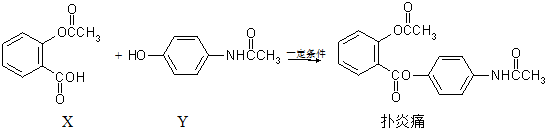
| A. | 扑炎痛的分子式为C17H16NO5 | |
| B. | 可用FeCl3溶液检验扑炎痛中是否含有化合物Y | |
| C. | 扑炎痛在酸性条件下水解最终可以得到3种物质 | |
| D. | 1 mol扑炎痛与足量的NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
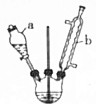 己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下:
己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下: +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
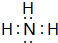 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+.
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤燃烧时,化学能主要转化为热能 | |
| B. | 白炽灯工作时,电能转化为光能 | |
| C. | 电解水生成氢气和氧气时,化学能转化为电能 | |
| D. | 绿色植物进行光合作用时,太阳能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH3 | B. | 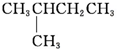 | C. |  | D. | 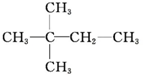 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com