
分析 (1)根据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算;
(2)根据n=$\frac{m}{M}$可知,质量相同时,摩尔质量越大,物质的量越小,则同温同压下体积与物质的量成正比;由pM=ρRT可知,密度与摩尔质量成正比;
(3)根据M=$\frac{m}{n}$计算摩尔质量,摩尔质量以g/mol为单位时,在数值上等于相对原子质量(或相对分子质量);
(4)利用n=$\frac{m}{M}$计算物质的量及其比值,利用构成来计算原子个数比,利用总质量与总物质的量来计算混合气体的平均摩尔质量.
解答 解:(1)由n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$可知,N2、CO2、SO2三种气体的物质的量比为1:1:1时.它们的分子个数比为1:1:1,同温同压下Vm相等,则体积之比为1:1:1,
质量之比等于摩尔质量之比,为28:44:64=7:11:16,
故答案为:1:1:1;7:11:16;1:1:1;
(2)设质量均为mg,
则物质的量分别为$\frac{m}{44}$mol、$\frac{m}{2}$mol、$\frac{m}{M}$mol、$\frac{m}{16}$mol,
同温同压下体积与物质的量成正比,则所占的体积由大到小的顺序是②④③①;
由pM=ρRT可知,密度与摩尔质量成正比,即摩尔质量越大,密度越大,
64>44>32>16>2,即密度由大到小的顺序为①③④②,
故答案为:②④③①;①③④②;
(3)22.2g CaR2含R-0.4mol,则CaR2的物质的量为0.2mol,所以M=$\frac{m}{n}$=$\frac{22.2g}{0.2mol}$=111g/mol,R的相对原子质量为$\frac{1}{2}$×(111-40)=35.5;
故答案为:111g/mol;35.5;
(4)由质量比为14:15的N2和NO混合,设混合气体中N2和NO的质量分别为28g、30g,
则N2的物质的量为$\frac{28g}{28g/mol}$=1mol,NO的物质的量为$\frac{30g}{30g/mol}$=1mol,
即混合气体中N2和NO的物质的量之比为1mol:1mol=1:1,
氮原子和氧原子的个数比为(1mol×2+1mol):1mol=3:1,
该混合气体的平均摩尔质量为$\frac{28g+30g}{1mol+1mol}$=29g/mol,
故答案为:1:1;3:1;29g/mol.
点评 本题主要考查阿伏伽德罗定律的应用、物质的量的计算,题目难度中等,注意质量守恒定律、摩尔质量在数值上等于其相对分子质量等概念的运用,试题侧重对学生能力的培养和解题方法的指导和训练.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在,Na+可能存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6和C4H8互为同系物 | |
| B. | CH2Cl2有2种同分异构体 | |
| C. | 苯乙烯分子中的所有原子不可能处于同一个平面 | |
| D. | 乙酸与乙醇的酯化反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
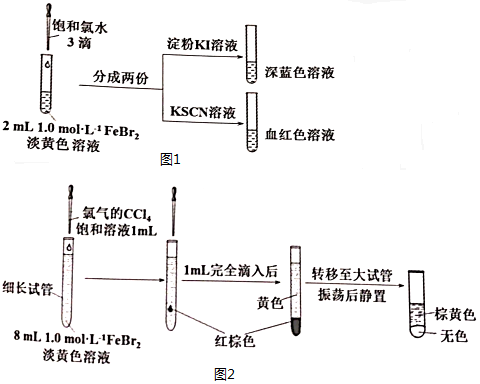
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| N(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③⑥ | C. | ②③ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 金刚石和氯化钾的熔化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com