
|
金属材料在日常生活以及生产中有着广泛的运用.下列关于金属的一些说法不正确的是 | |
A. |
合金的性质与其成分金属的性质不完全相同 |
B. |
工业上金属Mg、Al都是用电解熔融的氯化物制得的 |
C. |
金属冶炼的本质是金属阳离子得到电子变成金属原子 |
D. |
越活泼的金属越难冶炼 |
科目:高中化学 来源: 题型:022
电池在人们的日常生活、工农业生产、教学、科研等各个方面具有广泛的应 用。电池按不同的划分标准可以划分为不同的种类,用氧化还原反应设计的电池统称 为化学电源。
(1) 化学电源能够把________能转化为________能。组成原电池的条件 之一是________插入电解质溶液中。下列属于化学电源的有_________。①蓄电池 ② 锌锰电池③充电电池④一次性电池
(2)化学电源的组成可以表示为:(一)负极材料‖A‖正极材料(+)。A表示________,
离子在A中的电阻比电子在金属中的电阻________。对于不漏电的电池电子A中 ________(填通过、不通过)。
(3)1991年Sony公司首次推出商品化的锂离子电池,此后锂离子电池,此后锂子电 池的厂家如雨后春笋般在全世界出现,锂离子电池的品种和数量也在逐年增加。锂离 子电池的电压高,单个电池的电压是3.6V。锂离子电池的正极材料是锂的过渡金属氧 化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负级材料 是可插入锂的碳材料。
①锂在元素周期表中位于第________周期,第________族。②锂离子电池所用的下负 极材料都是不污染环境的无毒无害物质,作为密封电池无毒无害,可以放心使用,属 于绿色能源。而铝镍在生产过程中污染环境。铝镍电池的有毒物质是________,它作 为电池的________级。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年重庆市重庆一中高一4月月考化学试卷(带解析) 题型:填空题
人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
负极反应式为 。
正极反应式为 。
(2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为 ,若将此反应设计成原电池,则负极所用电极材料为 ,正极反应式为 。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为 。
| A.铝片、铜片 | B.铜片、铝片 | C.铝片、铝片 | D.铜片、铜片 |
查看答案和解析>>
科目:高中化学 来源:2015届重庆市高一4月月考化学试卷(解析版) 题型:填空题
人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
负极反应式为 。
正极反应式为 。
(2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为 ,若将此反应设计成原电池,则负极所用电极材料为 ,正极反应式为 。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为 。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式: 。
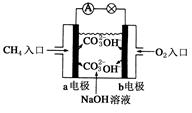
(4)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题:
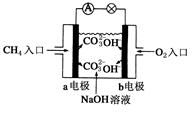
①电池的负极是__________(填“a”或“b”),该极的电极反应式是:________________。
②电池工作一段时间后电解质溶液的pH_________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省高一下学期第一次月考化学试卷 题型:选择题
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.这几种元素在自然界中都不能以游离态存在
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应
C. C、D、E的半径:C〉D〉E
D.化合物AE与CE具有相同类型的化学键
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com