


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
 H++B(OH)4-,该反应中的碱是 (填H3BO3或H2O);
H++B(OH)4-,该反应中的碱是 (填H3BO3或H2O);查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B.c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| C.c(NH4+)+c(NH3·H2O)=0.10mol·L-1 |
| D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(c)(a)(b)(d)(f)(e)(g) | B.(c)(a)(d)(f)(b)(e)(g) |
| C.(g)(e)(b)(f)(d)(a)(c) | D.(c)(a)(d)(f)(e)(b)(g) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.仅有①④ | B.仅有②③ | C.仅有①③ | D.全不正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.当c( )=c(A-)时,a一定等于20 )=c(A-)时,a一定等于20 |
B.当c( )>c(A-)时,a一定大于20 )>c(A-)时,a一定大于20 |
| C.当c(H+)>c(OH-)时,a一定小于20 |
D.当pH=7时,c( )=c(A-)=c(H+)=c(OH-) )=c(A-)=c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.若a=b,且 ,则相同条件时,酸性 ,则相同条件时,酸性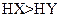 |
B.若a=b,且 ,则相同条件时,酸性 ,则相同条件时,酸性 |
C.若a>b,且 ,则相同条件时,酸性HX<HY ,则相同条件时,酸性HX<HY |
D.若等体积混合,且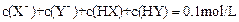 ,则一定有 ,则一定有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com