


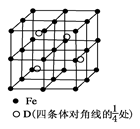




科目:高中化学 来源:不详 题型:单选题
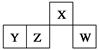
| A.原子半径:rW>rZ>rY>rX |
| B.含Y元素的盐溶液一定显酸性 |
| C.最简单气态氢化物的热稳定性:Z>W |
| D.X与氢元素组成的化合物XH5与水反应可产生两种气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.质子数c>b |
| B.原子半径X<W |
| C.氢化物的稳定性H2Y>HZ |
| D.离子的还原性Y2->Z- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.18O2与16O2性质完全相同 | B.N4=2N2是化学变化 |
| C.N4和N2互为同位素 | D.18O2中含18个中子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X、M两种元素形成的化合物只能存在离子键 |
| B.元素Y、Z、W形成的单质中,每1 mol它们的单质均含有NA个分子 |
| C.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
| D.元素W和M的某些单质可作为水处理中的消毒剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径: A>B>D>C | B.原子序数: d>c>b>a |
| C.离子半径: C>D>B>A | D.单质的还原性: A>B>D>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com