
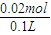 =0.2mol/L����D��ȷ��
=0.2mol/L����D��ȷ��

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���������һ��2010-2011ѧ������ڶ����¿������ ���ͣ�ѡ����
�������ӷ���ʽ��д����ȷ����
|
A��������������Һ����μ�������������Һ��ǡ�ó����ԣ� Ba2++2OH-+2H++SO42-====BaSO4��+2H2O |
|
B���ڱ�������Һ��ͨ������������̼��C6H5O-+H2O+CO2��C6H5OH+HCO3- |
|
C���ڳ���ʯ��ˮ�еμӹ���̼��������Һ�� Ca2++2HCO3-+2OH-====CaCO3��+2H2O+ CO32- |
|
D����100mL0.2mol/L�廯��������Һ������ͨ��448mL����״����Cl2�� |
2Fe2++4Br-+3Cl2====2Fe3++2Br2+6Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com