
【题目】短周期主族元素及其化合物在生产生活中至关重要。
(1)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中含有的化学键包括____________________。
(2) NF3与NH3的空间构型相同,但NF3不易与Cu2+等形成配位键,其原因是___________。
(3)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有阴阳离子各一种,结构是正四面体型离子和正八面体型离子;正八面体型离子的化学式为_________________________;正四面体型离子中键角大于PCl3的键角原因为______________________________________________________。
(4)氯化钠的晶胞结构如图所示,图是氯化钠的晶胞截面图(图中球大小代表半径大小)。已知NA代表阿伏加德罗常数的值,氯化钠晶体的密度为d g·cm-3。则Na+半径为____________pm(只需列出计算式)。
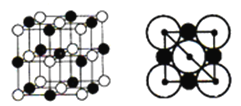
(5)砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:
B: (0,0,0); (![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() );……
);……
As:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );……
);……
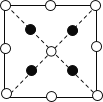
①请在图中画出砷化硼晶胞的俯视图______。
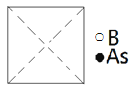
②砷原子紧邻的硼原子有________个,与每个硼原子紧邻的硼原子有______个。
【答案】共价键、配位 F的电负性比N大,NF成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子 PCl6— 两者磷原子均采取sp3杂化,PCl3分子中P原子有一对孤电子对,孤电子和对成键电子对斥力更大,PCl4+中P没有孤电子对,正四面体形阳离子中键角大于PCl3的键角 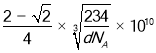
 4 12
4 12
【解析】
(1)①根据Q的结构分析判断;
(2)Cu2+提供空轨道,NH3和NF3中的中心原子N原子提供孤电子对,根据NH3和NF3中共用电子对的偏转判断;
(3)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,根据正四面体形阳离子和正六面体形阴离子分析判断;结合孤电子对对成键电子的排斥力大于成键电子对间的排斥力,判断PCl3与正四面体形阳离子中键角的大小;
(4)晶胞棱长=2×(Cl-离子半径+Na+离子半径),而晶胞棱长=2![]() ×Cl-离子半径,结合晶胞中各原子数目计算晶胞质量,结合密度计算晶胞体积,再计算晶胞棱长;
×Cl-离子半径,结合晶胞中各原子数目计算晶胞质量,结合密度计算晶胞体积,再计算晶胞棱长;
(5)①砷化硼为立方晶系晶体,根据晶胞中原子的分数坐标画出砷化硼的晶胞结构图,再画出砷化硼晶胞的俯视图;②根据①中画出的砷化硼的晶胞结构图分析判断。
(1)由Q的结构( )可知,Q分子中存在氢键、共价键、配位键(O与B之间)、分子间作用力,其中属于化学键的有共价键、配位键,故答案为:共价键、配位键;
)可知,Q分子中存在氢键、共价键、配位键(O与B之间)、分子间作用力,其中属于化学键的有共价键、配位键,故答案为:共价键、配位键;
(2)在形成的配合物中,Cu2+提供空轨道,NH3和NF3中的中心原子N原子提供孤电子对,由于N、F、H三种元素的电负性为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键,故答案为:F的电负性比N大,NF成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
(3)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正八面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-;PCl3中价层电子对个数=σ键个数+孤电子对个数=3+![]() =4,所以原子杂化方式是sp3,PCl4+中价层电子对个数=σ键个数+孤电子对个数=4+
=4,所以原子杂化方式是sp3,PCl4+中价层电子对个数=σ键个数+孤电子对个数=4+![]() =4,所以原子杂化方式是sp3,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以PCl4+中键角大于于PCl3的键角,故答案为:PCl6-;两者磷原子均采取sp3杂化,PCl3分子中P原子有一对孤电子对,孤电子和对成键电子对斥力更大,PCl4+中P没有孤电子对,正四面体形阳离子中键角大于PCl3的键角;
=4,所以原子杂化方式是sp3,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以PCl4+中键角大于于PCl3的键角,故答案为:PCl6-;两者磷原子均采取sp3杂化,PCl3分子中P原子有一对孤电子对,孤电子和对成键电子对斥力更大,PCl4+中P没有孤电子对,正四面体形阳离子中键角大于PCl3的键角;
(4)晶胞棱长=2×(Cl-离子半径+Na+离子半径),而晶胞棱长=2![]() ×Cl -离子半径,晶胞质量=
×Cl -离子半径,晶胞质量=![]() g,晶胞体积=
g,晶胞体积=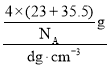 =
=![]() cm3,故晶胞棱长=
cm3,故晶胞棱长=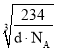 cm,则Cl -离子半径=
cm,则Cl -离子半径=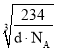 cm÷2
cm÷2![]() =
=![]() ×
×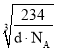 cm,Na+离子半径=
cm,Na+离子半径=![]() ×
×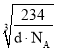 cm-
cm-![]() ×
×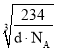 cm=
cm=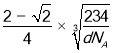 cm=
cm= 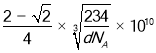 pm,故答案为:
pm,故答案为: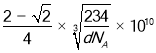 ;
;
(5)①砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:B: (0,0,0); (![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() );……;As:(
);……;As:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );……;则砷化硼的晶胞结构图为
);……;则砷化硼的晶胞结构图为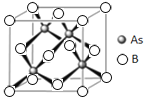 ,因此砷化硼晶胞的俯视图为
,因此砷化硼晶胞的俯视图为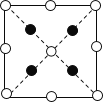 ,故答案为:
,故答案为: ;
;
②As与周围紧邻的4个B原子形成正四面体;以顶点B原子研究,与之紧邻的硼原子处于面心,每个顶点为8个晶胞共用,与每个硼原子紧邻的硼原子数目为![]() =12,故答案为:4;12。
=12,故答案为:4;12。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】25℃时,体积均为25.00mL,浓度均为0.0100mo1L-1的HA、H3B溶液分别用0.0100mo1L-1NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法正确的是( )
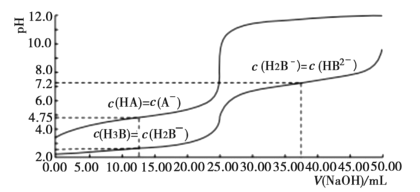
A.25℃时,0.0100mo1L-1Na2HB溶液的pH>7
B.向HA溶液中滴加NaOH溶液至中性,c(A-)<c(HA)
C.NaOH溶液滴定HA溶液应选甲基橙作指示剂
D.25℃时,H2B-离子的水解常数的数量级为10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4X(X为卤素原子)有关转化过程的能量关系如图所示。下列说法不正确的是

A.ΔH1>ΔH4
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
C.因为NH4Cl固体溶于水吸热,所以ΔH6<0
D.相同条件下,NH4Br的(ΔH2+ΔH3+ΔH5)比NH4I的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热播电视剧《破冰行动》中曾经多次提到一种叫东莨菪碱(Scopolamine)的化学物质。东莨菪碱是1892年由E.施密特首先从东莨菪中分离出来,可用于麻醉、镇痛、止咳、平喘,对动晕症有效。但其毒性较强,稍一过量服用即可致命,具有极高的致幻作用,称为“魔鬼呼吸”。其结构如下图,下列说法不正确的是( )
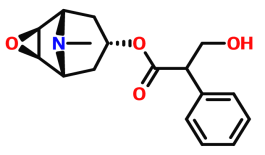
A. 分子间可以形成分子间氢键
B. 东莨菪碱的化学式为C17H21NO4
C. 该物质能发生加成、取代和氧化反应
D. 可使用质谱仪测出这个分子的相对分子质量,也可用核磁共振氢谱确定这个分子的环状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2O2(l)=2H2O(l)+O2(g) ΔH=-akJ·mol-1(a>0)
(1)KI溶液可作为H2O2分解反应的催化剂,催化过程按以下两步反应进行:
Ⅰ.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) ΔH1=+bkJ·mol-1(b>0)
Ⅱ.__ ΔH2=__kJ·mol-1(用含a和b的代数式表示)
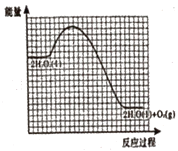
①请将上述过程补充完整(提示:反应Ⅱ不是分解反应)。
②已知:相同条件下,反应Ⅰ的反应速率小于反应Ⅱ的反应速率。如图为未加催化剂时H2O2分解反应的能量-反应历程示意图,请在图中画出加入KI溶液后该反应的能量-反应历程示意图___。
(2)H2O2的水溶液呈弱酸性,其电离过程如下:H2O2H++HO2-;HO2-H++O22-
某温度下,其电离平衡常数K1=1.1×10-11,则质量分数为30%(物质的量浓度为10mol·L-1)的H2O2水溶液的pH≈__。(忽略H2O2的二级电离及水的电离)。
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。然后保持其它初始条件不变,改变温度![]() ,重复上述实验。获得V(O2)(转化成标况下的体积)~T关系曲线。下列趋势图可能符合实测V(O2)~T关系曲线的是__,原因是__。
,重复上述实验。获得V(O2)(转化成标况下的体积)~T关系曲线。下列趋势图可能符合实测V(O2)~T关系曲线的是__,原因是__。
A.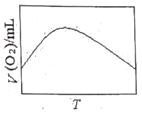 B.
B.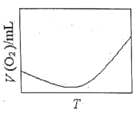
C.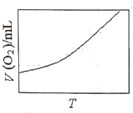 D.
D.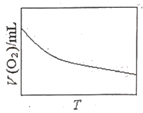
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示用酸性氢氧燃料电池为电源进行的电解实验。下列说法中正确的是( )
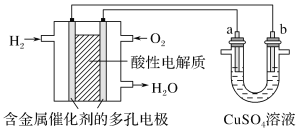
A. 燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,a极上产生的O2与电池中消耗的 H2体积比为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是原子序数依次增大的短周期元素,且
是原子序数依次增大的短周期元素,且![]() 原子序数之和是
原子序数之和是![]() 原子序数之和的
原子序数之和的![]() 。甲、乙、丙、丁是由这些元素组成的二元化合物,
。甲、乙、丙、丁是由这些元素组成的二元化合物,![]() 是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物
是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物![]() 是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是
是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 由四种元素形成的两种盐,水溶液中反应能生成![]()
B. ![]() 与
与![]() 形成的化合物中阴、阳离子个数比可为1:1
形成的化合物中阴、阳离子个数比可为1:1
C. 化合物![]() 、乙烯使溴水褪色的原理相同
、乙烯使溴水褪色的原理相同
D. ![]() 与
与![]() 形成的化合物中,成键原子均满足8电子结构
形成的化合物中,成键原子均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
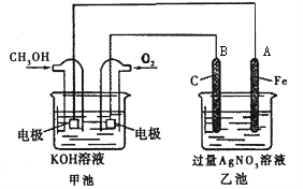
(1)放电时:正极参加反应气体22.4L(标准状况下),则转移电子的物质的量为___。
(2)在此过程中若完全反应,乙池中A极的质量增加216 g,则乙池中c(H+)=______(反应后溶液体积为2000mL)。
(3)若在常温常压下,1gCH3OH燃烧生成CO2和液态H2O时放热22.68kJ,表示甲醇燃烧热的热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲烷为原料合成部分化工产品流程如图(部分反应条件已略去) ,已知 A 和甲是来自石油和煤的两种基本化工原料。A 是气态烃,甲是液态烃。A 是常见的植物生长调节剂,75% 的B 溶液可用于杀死“新冠”病毒,D 是高分子化合物。
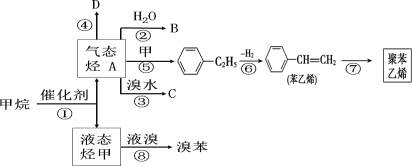
(1)A 的结构简式为_______,B 中官能团名称为_____,C 的名称为_____。
(2)在反应②、③、⑥、⑧中,属于加成反应的是_____,属于取代反应的是_____。(填序号)
(3)写出下列反应的化学方程式并注明反应条件。
反应②:_____;
反应⑦:_____;
反应⑧:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com