
| A. | l mol H20最多可形成氢键数目为2NA | |
| B. | 标准状况下,11.2 L甲醛所含的σ键数目为2NA | |
| C. | 常温下,46 g N02所含分子数目为NA | |
| D. | pH=l的硫酸中所含S042-的数目为0.05NA |
分析 A、一个水分子能形成2个氢键;
B、求出甲醛的物质的量,然后根据1mol甲醛中含3molσ键来分析;
C、N02中存在平衡:2N02?N204;
D、溶液体积不明确.
解答 解:A、一个水分子能形成2个氢键,故1mol水可以形成2mol氢键即2NA个,故A正确;
B、标况下11.2L甲醛的物质的量为0.5mol,而1mol甲醛中含3molσ键,故0.5mol甲醛中含1.5molσ键即1.5NA个,故B错误;
C、N02中存在平衡:2N02?N204,故46gNO2中的分子个数小于NA个,故C错误;
D、溶液体积不明确,故溶液中的硫酸根的个数无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某溶液可能含有如表离子
某溶液可能含有如表离子| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0 | B. | +2 | C. | +3 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
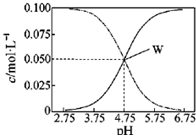 25℃,有c(CH3COOH)+c(CH3COO-)=0.l mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.l mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )| A. | pH=5.5溶液中:c(CH3COO->c(CH3COOH)>c(H+)>c(OH一) | |
| B. | W点表示溶液中:c(Na+)=c(CH3COO-) | |
| C. | pH=3.5溶液中:c(Na+)-c(OH-)+c(CH3COOH)=0.l moL/L | |
| D. | 向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05molNa2O2固体中含有的阴离子数均为0.05NA | |
| B. | 标准状况下,2.24LCH4所含的原子数为0.1NA | |
| C. | 1molSO2与足量O2在一定条件下反应,共转移2NA个电子 | |
| D. | 1L0.1mol/L氨水中含有的NH3•H2O分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀释前,溶液pH:①>②=③ | |
| B. | 稀释后,溶液pH:①>②=③ | |
| C. | 稀释前,溶液中溶质的物质的量浓度:③>①=② | |
| D. | 稀释后,溶液中溶质的物质的量浓度:③>①=② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com