
【题目】某烃在标准状况下的密度为3.215 g/L,现取3.6 g该烃完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4 g,碱石灰增重11 g,求:
(1)该烃分子的摩尔质量。
(2)确定该烃的分子式。
(3)已知该烃的一氯代物只有一种,写出该烃的结构简式。
【答案】(1)72 g·mol-1 (2)C5H12 (3) ![]()
【解析】
试题分析:(1)烃的摩尔质量为3.215g/L×22.4L/mol=72g/mol,摩尔质量以g/mol作单位,数值上等于其相对分子质量;所以该烃的相对分子质量为72;
(2)生成水的物质的量为n(H2O)=![]() =0.3mol,所以n(H)=2n(H2O)=0.3mol×2=0.6mol
=0.3mol,所以n(H)=2n(H2O)=0.3mol×2=0.6mol
生成CO2的物质的量为n(CO2)=![]() =0.25mol,所以n(C)=n(CO2)=0.25mol,烃中C原子、H原子的个数比为0.25mol:0.6mol=5:12,实验式为C5H12,实验式中C原子与H原子的关系满足烷烃关系,实验式即是分子式,所以该烃的分子式为C5H12;
=0.25mol,所以n(C)=n(CO2)=0.25mol,烃中C原子、H原子的个数比为0.25mol:0.6mol=5:12,实验式为C5H12,实验式中C原子与H原子的关系满足烷烃关系,实验式即是分子式,所以该烃的分子式为C5H12;
(3)分子中只有一种H原子,C5H12是烷烃,所以H原子一定位于甲基上,所以甲基数目为![]()
=4,剩余的1个C原子通过单键连接4个甲基,结构简式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】(1)反应3A(g)+B(g) ===2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L·min)、②vC=0.5 mol/(L·min)、③vB=0.5 mol/(L·min),三种情况下该反应速率由大到小的关系是 。(用序号表示)
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
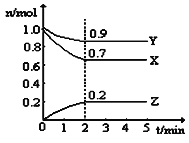
①该反应的化学方程式为__________________________。
②反应开始至2min,以气体Z表示的平均反应速率为 。
③2min反应达平衡容器内混合气体的平均相对分子质量比起始时 (填“大”,“小”或“相等”,下同),混合气体密度比起始时 。
④上述反应,在第2min时,X的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L pH=10的NaOH溶液中持续通入CO2。通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示。下列叙述不正确的是
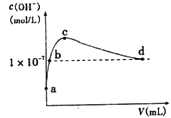
A.d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-)
B.c点溶液中:c(Na+)>c(HCO3-)>c(CO32-)
C.b点溶液中:c(H+)=1×10-7mol·L-1
D.a点溶液中:水电离出的c(H+)=1×10-10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D、E能发生如图所示的转化。请完成下面有关问题:
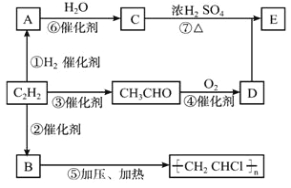
(1)C中官能团的名称 。
(2)反应②的化学方程式 ,反应类型为 。
(3)某烃X的最简式与上述C2H2的相同,X蒸汽相对氢气的密度为39。现取两支试管,分别加入适量溴水,实验操作及现象如下:
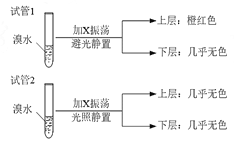
有关X的说法正确的是
A.X难溶于水
B.煤炭中含有这种烃
C.X使溴水褪色是因为发生加成反应
D.试验后试管2中的有机层是上层还是下层,可通过加水确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用自来水养金鱼,在将水注入鱼缸之前,常须把水在阳光下曝晒一段时间,其目的是( )
A.增加水中的含氧量
B.起到杀菌作用
C.使水中的次氯酸分解
D.使水的硬度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钠(Na3N)是科学家制备的一种重要化合物。它与水作用可生成NH3 和一种强碱。回答下列问题:
(1)氮化钠的电子式是 ,该化合物是 化合物(选填“离子”、“共价”)。
(2)氮化钠与水反应的化学方程式是 ,该反应属于 反应。
(3)氮化钠与盐酸反应生成 种盐,其中 (填盐的化学式)既含离子键又含有共价键。
(4)氮化钠中两种微粒的半径大小比较: r(Na+) r(N3-)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关天然产物水解的叙述不正确的是
A.油脂水解可得到丙三醇
B.麦芽糖水解只生成葡萄糖
C.蛋白质水解的最终产物均为氨基酸
D.纤维素水解与淀粉水解得到的最终产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】量取16.0mL 10.0molL﹣1HCl溶液,加蒸馏水稀释至100mL,取两份稀释后的HCl溶液各25mL,分别加入等质量的Mg和Al,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积),请计算:

(1)稀释后HCl溶液的物质的量浓度为 mol·L-1。
(2)加入Al的质量至少有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修2:化学与技术)熔炼法是工业上回收镁合金废料的常用方法,其流程为:
![]()
(1)废料预处理
①粉碎:有干态机械粉碎法和湿喷机械粉碎法,其中容易造成危险的方法是 ,理由是 。
②除油污和油漆:把油污和油漆一次性除去最适宜的方法是 。
a.用热碱洗涤,过滤
b.用有机溶剂溶解,过滤
c.加热气化除去
(2)镁合金在加热到935K时熔化,并不断向其中通入氩气做保护气。若用二氧化碳做保护气,可能造成的后果是 (用化学方程式表示)。
(3)熔融镁中的杂质铁可加入固体硼砂(B2O3)除去,生成FeB2沉渣,其化学反应方程式为 。
(4)镁合金除了含有铁之外,还含有少量铝。加入C2Cl6可以除去液态镁中的氢气,还能把铝转化为Al4 C3沉渣:
C2Cl6=2C+3Cl2 3C+4Al=Al4C3
①除气除渣炉排出的污染性气体有 。
②如果1t镁合金中,铝占3.6‰,则除去铝最少需要加入C2Cl6 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com