
| A. | 石油裂解可以得到氯乙烯 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 所有烷烃和蛋白质中都存在碳碳单键 | |
| D. | 淀粉和纤维素水解的最终产物都是葡萄糖 |
分析 A、石油裂解的主要目的是获得”三烯“;
B、油脂是高级脂肪酸的甘油酯;
C、甲烷中无碳碳单键;
D、淀粉和纤维素均为葡萄糖的脱水缩合物.
解答 解:A、石油裂解的主要目的是获得”三烯“,特别是提高乙烯的产量,不能获得氯乙烯,故A错误;
B、油脂是高级脂肪酸的甘油酯,故油脂水解得到的高级脂肪酸(或高脂肪酸盐)和甘油,故B错误;
C、甲烷是最简单的烷烃,结构中只有一个碳原子,故结构中无碳碳单键,故C错误;
D、淀粉和纤维素均为葡萄糖的脱水缩合物,故淀粉和纤维素水解的最终产物均为葡萄糖,故D正确.
故选D.
点评 本题考查了糖类、油脂和蛋白质的结构和性质特点,应注意的是烯烃中一定含碳碳双键,而烷烃中不一定含碳碳单键.


科目:高中化学 来源: 题型:解答题
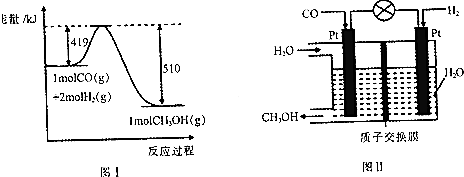
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
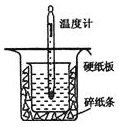 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 称量药品时间过长 | |
| C. | 定容时俯视液面 | |
| D. | 洗涤烧杯和玻棒的溶液转入容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 氢氟酸具有酸性,可用于雕刻玻璃 | |
| C. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| D. | NH3具有还原性,可用NH3与灼热CuO作用制取少量N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
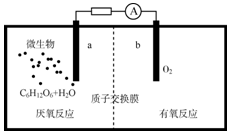
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com