
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 9.0 ,升温使其汽化,测其密度是相同条件下氢气的45倍。 | (1)A的相对分子质量为:___________。 |
(2)将此9.0 gA在足量纯氧气中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。 | (2)A的分子式为:_______________________。 |
(3)另取A 9.0 g,跟足量的碳酸氢钠粉末反应,生成2.24 LCO2(标准状况),若与足量金属钠反应则生成2.24 L氢气(标准状况)。 | (3)写出A中含有的官能团:____、_____。 |
(4)A的核磁共振氢谱如下图:
| (4)A中含有______种氢原子。 |
(5)综上所述A的结构简式_______________________。 | |
【答案】90C3H6O3羧基羟基4![]()
【解析】
(1)根据相对密度之比等于相对分子质量之比,故A的相对分子质量为:45![]() 2=90;
2=90;
(2)利用有机物燃烧的方程式计算:CxHy+![]() O2
O2 ![]() xCO2+
xCO2+![]() H2O,浓硫酸增重5.4 g表明生成的H2O为5.4g,即0.3mol, 碱石灰又增重了13.2 g表明生成的CO2为13.2 g,即0.3mol。x:y=1:2。根据质量守恒定律可知,氧气的质量为16g,即1mol,经过计算,得知x:z=1:1,综合为:x:y:z=1:3:1。又指A的物质的量为9.0g/(90g/mol)=0.1mol,因此,x=3、y=6、z=3,故A的分子式为C3H6O3;
H2O,浓硫酸增重5.4 g表明生成的H2O为5.4g,即0.3mol, 碱石灰又增重了13.2 g表明生成的CO2为13.2 g,即0.3mol。x:y=1:2。根据质量守恒定律可知,氧气的质量为16g,即1mol,经过计算,得知x:z=1:1,综合为:x:y:z=1:3:1。又指A的物质的量为9.0g/(90g/mol)=0.1mol,因此,x=3、y=6、z=3,故A的分子式为C3H6O3;
(3)1molA与NaHCO3反应生成1molCO2,说明A中含有一个羧基;1molA与Na反应生成1molH2,说明A中含有一个羧基和一个羟基;
(4)根据A的核磁共振氢谱可以看出共有四个峰,说明含有4种不同的氢原子;(5)综上所述A的分子式为C3H6O3,含有一个羧基和一个羟基,结构简式为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Mg原子最外层电子数为_____,反应中容易________个电子而显示_____价; F原子最外层电子数为_____,反应中容易__________个电子而显示_____价。在上述过程中,F原子和 Mg原子通过_____________都形成了8电子稳定结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)氯碱工业中电解饱和食盐水流程及原理示意图如下图所示。
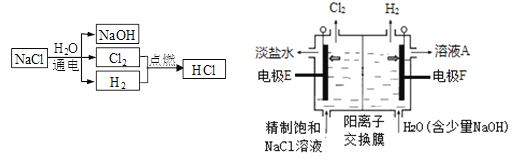
(1)生成H2的电极反应式是_________________________________________。
(2)Na+向________(填“E”或“F”)方向移动,溶液A的溶质是______________。
(3)电解饱和食盐水总反应的离子方程式是_____________________________。
(4)常温下,将氯碱工业的附属产品盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表。
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液pH |
① | 0.1 | 0.1 | pH=5 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>7 |
ⅰ. 实验①中所得混合溶液,由水电离出的c(H+)=______ mol·L-1。
ⅱ. 实验②中,c______0.2(填“>”“<”或“=”)。
ⅲ. 实验③中所得混合溶液,各离子浓度由大到小的顺序是__________________。
ⅳ. 实验①、③所用氨水中的![]() :①___________③(填“>”“<”或“=”)。
:①___________③(填“>”“<”或“=”)。
(5)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中的Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如下图所示。

下列表述正确的是_______。
A. 氯处理饮用水时,在夏季的杀菌效果比在冬季好
B. 在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C. 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时效果差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (ρ水=1g/cm3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。

(1)装置a的名称是__________________,主要作用是____________________。
(2)三颈瓶中发生反应的化学方程式为_______________________________________,此反应的原子利用率理论上可达___________。(原子利用率=(期望产物的总质量/全部反应物的总质量)×100%)
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是________________________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过 ________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合震荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:

回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______________________________g·cm-3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为________nm。
所形成的正八面体的体心,该正八面体的边长为________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数。
(1)已知一个NO、NO2分子的质量分别是ag、bg。则一个氧原子的质量是________,氧原子的摩尔质量是(用含a、b数字的式子表示)________,10 g NO2物质的量为(用含b的式子表示)________。
(2)已知H2+Cl2![]() 2HCl,在某密闭容器中使NA个Cl2与2 mol H2充分反应后,容器中气体分子数目为________NA,此时气体总质量为________。
2HCl,在某密闭容器中使NA个Cl2与2 mol H2充分反应后,容器中气体分子数目为________NA,此时气体总质量为________。
(3)含有NA个OH-的Ca(OH)2的质量是________,n(Ca2+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中![]() I的含量变化来检测核电 站是否发生放射性物质泄漏。下列有关
I的含量变化来检测核电 站是否发生放射性物质泄漏。下列有关![]() I的叙述中错误的是( )
I的叙述中错误的是( )
A. ![]() I的化学性质与
I的化学性质与![]() I相同B.
I相同B. ![]() I的原子核外电子数为78
I的原子核外电子数为78
C. ![]() I的原子序数为53D.
I的原子序数为53D. ![]() I的原子核内中子数多于质子数
I的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,硫氢化钾溶液里存在下列平衡:
a.HS-+H2O![]() OH-+H2S b.HS-
OH-+H2S b.HS-![]() H++S2-
H++S2-
(1)平衡a是_________平衡;平衡b是_________平衡。(填“电离”或“水解”)
(2)向KHS溶液中加入氢氧化钠固体时,c(S2-)将_________(填“增大”“城小”或“不变”。下同);向KHS溶液中通入HCl时,c(HS-)将_________。
(3)向KHS溶液中加入硫酸铜溶液时,有黑色沉淀(CuS)产生,则平衡a_________(填“正向”“逆向”或“不”,下同)移动,平衡b_________移动;溶液的pH_________(填“增大”“減小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液流式铅蓄电池以可溶性的甲基磺酸铅[(CH3SO3)2Pb]代替硫酸作为电解质溶液,该电池充放电的总反应为2Pb2++2H2O![]() Pb+PbO2+4H+,下列说法正确的是( )
Pb+PbO2+4H+,下列说法正确的是( )
A.该电池放电时,两极质量均增加
B.放电时,正极的电极反应式为PbO2+4H++2e-![]() Pb2++2H2O
Pb2++2H2O
C.充电时,溶液中Pb2+向阳极移动
D.充电时,阳极周围溶液的pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com