
将4 mol金属Al全部转化为Al(OH)3,消耗HCl a mol,NaOH b mol,则a+b的最小值为( )
A.4 B.6 C.8 D.16
【知识点】计算 A1 C2
【答案解析】B解析:生成4molAl(OH)3时,由反应方程式可知
方案①中:2Al+6H+=2Al3++3H2↑、Al3++3OH-=Al(OH)3↓+3NH4+,
即消耗4molAl时,消耗12molH+、12molOH-,则a+b=24
方案②中:2Al+2NaOH+2H2O=2NaAlO2+3H2↑、AlO2-+H2O+H+=Al(OH)3↓,
即消耗4molAl时,消耗4molH+、4molOH-,则a+b=8
方案③中:2Al+6H+=2Al3++3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑、Al3++3AlO2-+6H2O=4Al(OH)3↓,即消耗4molAl时,消耗3molH+、3molOH-,则a+b=6,显然方案③最好,药品用量少。
【思路点拨】用一部分铝与酸反应生成的Al3+代替酸与另外一部分铝和氢氧化钠反应生成的AlO2-反应生成氢氧化铝,则消耗的酸和碱都少些。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
油条是一种深受群众喜爱的传统食品,在百姓早餐桌上一直占有重要位置。但油条中铝含量超标问题十分普遍,是影响群众健康的食品安全隐患。从2009年5月下旬开始,浙江省的油条加工停用含铝的食品添加剂,逐步转换为无铝的食品添加剂配方和工艺,从而保证百姓吃上安全、放心的油条。油条无铝配方由碳酸氢钠(小苏打)和碳酸氢铵(臭粉)组成。为测定试样中小苏打的质量分数ω(NaHCO3),实验小组同学设计了如下装置进行实验。

实验过程:
①按上图组装仪器,检查装置的气密性;
②将试样m1 g放入硬质玻璃管中,装置B、C、D中药品如上 图,已知加药品后装置B的质量为m2 g、装置C的质量为m3 g;
图,已知加药品后装置B的质量为m2 g、装置C的质量为m3 g;
③关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B的质量为m4 g、装置C的质量为m5 g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(2)装置B的作用为
________________________________________________________________________;
装置C的作用为
________________________________________________________________________。
(3)实验过程中通入N2的目的为
________________________________________________________________________。
(4)用下列各项所提供的数据能计算出ω(NaHCO3)的是________(填选项字母)。
| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | m2、m3、m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m3、m5 |
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的ω(NaHCO3),若能,写出ω(NaHCO3)的计算式。
________(填“能”或“不能”),________(若不能,此空不作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g) 2XY3(g) △H=-92.6 kJ.mol-1
2XY3(g) △H=-92.6 kJ.mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | |||
| ① | 1 | 3 | 0 | 2分钟 | 放热46.3kJ |
| ② | 0.4 | 1.2 | 1.2 | / | Q(Q>0) |
下列叙述不正确的是
A. 容器①中反应从开始到刚达平衡时用XY3表示的反应速率为v(XY3)=1/30 moI.L-l·s-1
B. 平衡时,两个容器中XY3的物质的量浓度相等
C. 器②中反应达到平衡时吸收的热量为Q
D. 容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下在容积为 2L 的密闭容器中,发生反应 2X(g) + Y(g) 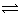 2W(g);△H<0,当充入 2 mol X 和 1 mol Y,经20 s达到平衡时生成了 0.4 molW。下列说法正确的是()
2W(g);△H<0,当充入 2 mol X 和 1 mol Y,经20 s达到平衡时生成了 0.4 molW。下列说法正确的是()
①升高温度,W 的体积分数减小,△H 增大
②以 Y 的浓度变化表示的反应速率为 0.01 mol/(L·s)
③在其它条件不变的情况下,增加 1 mol X ,则 X 和 Y 的转化率均提高
④增大压强,正反应速率增大,逆反应速率减小,则平衡向正反应方向移动
⑤再向容器中通入 2 mol X 和 1 mol Y,达到平衡时,X、Y 的转化率均增大。
A、①⑤ B、⑤ C、②③④ D、④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列有关NA 的叙述中正确的有
①标准状况下,20 g重水(D2O)中含有的电子数为10NA
②0.5 molFe2-被足量的H2O2溶液氧化,转移0.5 NA个电子
③将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA
④乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
⑤2 mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1 mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4 L的N2的共用电子对数为3NA
A、3个 B、4个 C、5个 D、全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA
B.常温常压下,7.0 g乙烯与丙烯的混合物中含有碳氢键的数目为NA
C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数
目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题:
(1)写出F元素的电子排布式________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为________。
(3)已知C、E两种元素合成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是________。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
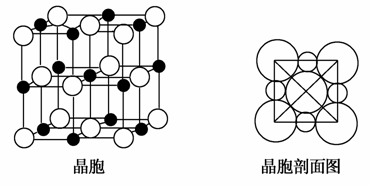
晶胞中距离一个B+最近的B+有________个。
若晶体密度为ρg·cm-3,阿伏加德罗常的值用NA表示,则E-的离子半径为________cm(用含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中发生反应N2+3H22NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间
的关系如图所示:
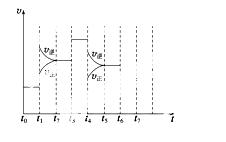
回答下列问题:
(1)处于平衡状态的时间段是________(填选项)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项)。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻________;t3时刻________;t4时刻________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________(填选项)。
A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com