
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
| 3 |
| ||
| 10-14 |
| 10-9 |


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
| A、X可能位于ⅠA族 |
| B、两元素形成的化合物中,原子个数比不可能是1:1 |
| C、X与Y的简单离子可能具有相同的电子层结构 |
| D、常温常压下,X2Y可能是气体、液体或固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
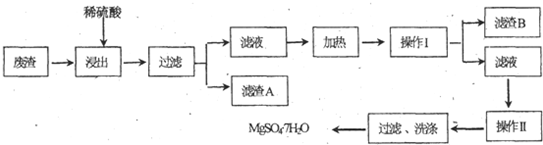

查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
| 沉淀完全时的pH | 3.7 | 5.2 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 除杂试剂 | ①酸性高锰酸钾溶液 ②溴水 ③饱和碳酸钠溶液 ④氢氧化钠溶液 |
| 提纯方法 | A蒸馏 B萃取 C分液 D洗气 |
| 甲 | 除杂试剂 | 提纯方法 |
| 甲烷(乙烯) | ||
| 乙酸乙酯(乙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | KMnO4溶液体积 | H 2C2O4溶液体积 | 硫酸溶液体积 | 温度 | 水的体积 |
| I | 2mL | 4mL | 4mL | 20℃ | 0 |
| II | 2mL | 4mL | 30℃ | 0 | |
| III | 1mL | 4mL | 4mL | 20℃ | 1mL |
| IV | 2mL | 2mL | 4mL | 20℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在原电池的负极和电解池的阴极上都发生失电子的氧化反应 |
| B、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
| C、镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
| D、用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com