
| A、NH4Cl溶液中:c(Cl-)+c(H+)=c(NH4+)+c(OH-)+2c(NH3.H2O) |
| B、Na2CO3和NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| C、等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:2c(K+)=c(X-)+c(HX)+c(H+) |
| D、pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:c(M+)=c(X-)>c(H+)=c(OH-) |


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
| A、1 mol O的质量是16 g/mol |
| B、Na的摩尔质量是23 g/mol |
| C、CO2的摩尔质量是44 g |
| D、氢的摩尔质量是2 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(OH)3胶体粒子所作的布朗运动 |
| B、在电场作用下,Fe(OH)3胶体粒子在分散剂里作定向移动 |
| C、当光束通过Fe(OH)3胶体时,可以看到一条光亮的“通路” |
| D、向Fe(OH)3胶体中逐滴加入盐酸时会观察到先变浑浊再变澄清 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
| B、硅胶可以除去氯气中的水蒸气 |
| C、明矾净水属于物理变化 |
| D、黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(ml) | 标准盐酸体积(ml) | |
| 滴定前刻度(ml) | 滴定后刻度(ml) | ||
| 第一次 | 10.00 | 0.20 | 20.50 |
| 第二次 | 10.00 | 0.40 | 20.80 |
| 第三次 | 10.00 | 4.00 | 24.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若m+n<p,温度不变,将容器体积缩小到原来的一半,则X的浓度大于原来的2倍 |
| B、若在密闭恒温容器中加入pmol的Z达到平衡,再加入一定量的Z,Z的百分比含量不变,则m+n=p |
C、若定温下Y的体积分数(Y%)与压强变化的关系如图所示,则a点表示平衡正向移动且反应速率:a点<b点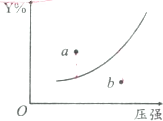 |
| D、若m+n=p,且在密闭恒容容器内进行,当温度升高时,平衡逆向移动,容器中气体的压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 制备阿司匹林的合成路线(用下面示例中的合成路线流程图表示,同时注意所选试剂的合理性).示例:CH2=CH2
制备阿司匹林的合成路线(用下面示例中的合成路线流程图表示,同时注意所选试剂的合理性).示例:CH2=CH2| HBr |
| NaOH |
| 水/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和的食盐水中通气体的最合适的方法是先通CO2,再通NH3 |
| B、该反应能发生的原因是NaHCO3的溶解度在几种物质中最小 |
| C、若制得的”碱“中混有少量的NaHCO3,应用过量的NaOH溶液除去 |
| D、用酚酞试液可鉴别制得”碱“液和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、NO3ˉ、Fe2+、Clˉ |
| B、SO42-、Mg2+、Clˉ、Na+ |
| C、SO42-、Na+、Mg2+、CH3COOˉ |
| D、Clˉ、SCNˉ、K+、Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com