
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
部分含钒物质在水中的溶解性如下:
回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热法,该反应的化学方程式为_______
(2)为了提高钒的浸出率,用酸浸使催化剂中的V2O5转变成可溶于水的VOSO4,与水浸液合并,再用KClO3氧化,使+4价的V氧化成易溶于水的(VO2)2SO4。反应①的离子方程式为_______;反应②的离子方程式为ClO3-+6VO2++3H2O=6VO2++6H++Cl-。
(3)该工艺中反应③的沉淀率是回收钒的关键之一,该步反应的离子方程式为_______。
(4) 实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取100g该废钒催化剂按工业生产的步骤进行实验,当加入100 mL 0.1 mol·L-1的KC1O3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是_______ (已知V2O5的相对分子质量为182)。
(5) 全钒液储能电池是利用不同价态的离子对之间的氧化还原反应来实现化学能和电能相互转化的装置,其原理如右下图所示。已知电池的总反应式为VO2++V2++2H+ VO2++V3++H2O
VO2++V3++H2O
①放电时的正极反应式为______________。
②放电过程中氢离子的作用是______________,充电时若转移的电子为2mol,则左槽溶液中n(H+)的变化量为______________。
(16分)(1)3V2O5+10Al 6V+5Al2O3 (2分) (2)①V2O5+SO32-+4H+=2VO2++SO42-+2H2O(3分)
6V+5Al2O3 (2分) (2)①V2O5+SO32-+4H+=2VO2++SO42-+2H2O(3分)
(3)NH4++VO3-=NH4VO3↓(2分) (4)91%(3分) (5)①VO2++2H++e-=VO2++H2O(2分)
②参与正极反应和通过交换膜定向移动使电流通过溶液(2分); 2mol(2分)
解析试题分析:(1)铝是活泼的金属,能和五氧化二钒发生铝热反应生成单质矾和氧化铝,反应的化学方程式为3V2O5+10Al 6V+5Al2O3。
6V+5Al2O3。
(2)根据溶解性表知,滤渣是V2O5,酸性条件下,V2O5和亚硫酸钠发生氧化还原反应生成VOSO4,反应的离子反应方程式为V2O5+SO32-+4H+=2VO2++SO42-+2H2O。
(3)反应③是复分解反应,反应的离子方程式是NH4++VO3-=NH4VO3↓。
(4)根据V2O5+SO32-+4H+=2VO2++SO42-+2H2O、ClO3-+6VO2++3H2O=6VO2++6H++Cl-可知:
3V2O5~6VO2+~ClO3-
3mol 1mol
n 0.01mol
所以n=0.03mol
因此该实验中钒的回收率是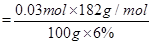 ×100%=91.0%
×100%=91.0%
(5)①原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应。根据总的方程式可知VO2+得到电子被还原为VO2+,因此正极电极反应式是VO2++2H++e-=VO2++H2O。
②根据①可知,放电时正极消耗氢离子,所以放电过程中氢离子的作用是参与正极反应和通过交换膜定向移动使电流通过溶液。根据装置图可知,充电时左槽电极和电源的正极相连,做阳极,电极反应式是VO2++H2O-e-=VO2++2H+,所以充电时若转移的电子为2mol,则左槽溶液中n(H+)的变化量为2mol。
考点:考查铝热反应;氧化还原反应方程式的书写和计算;原电池和电解池原理的有关应用和计算


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:填空题
合成氨工业中,原料气(N2、H2、混有少量CO、NH3)在进入合成塔之前,常用醋酸二氨合铜(Ⅰ)溶液来吸收CO,其反应为CH3COO[Cu(NH3)2]+CO+NH3
CH3COO[Cu(NH3)3]·CO(正反应为放热反应)。
(1)必须除去CO的原因是___________________________。
(2)醋酸二氨合铜(Ⅰ)溶液吸收原料气中CO的适宜条件是______________________。
(3)吸收CO后的醋酸铜(Ⅰ)氨溶液经适当处理又可再生,恢复其吸收CO的能力而循环使用,其再生的条件是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)【化学——化学与技术】
(1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用如图所示的工艺流程生产硫酸。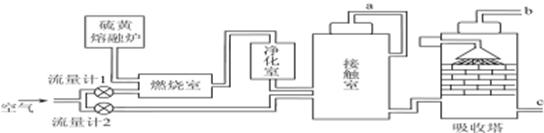
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是__________________________。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为________。(空气中氧气的体积分数按0.2计),该尾气的处理方法是____________________________________________。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是________。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面________(可多选)。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式__________________________________________、______________________________、___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2013年诺贝尔化学奖授予美国科学家马丁·卡普拉斯、迈克尔·莱维特、阿里耶·瓦谢勒,以表彰他们“在开发多尺度复杂化学系统模型方面所做的贡献”。这种用电脑取代木棒作试验模型,催生了现代化学研究手段的一次新飞跃。下列不属于现代化学对物质结构进行研究的手段的是
| A.X射线 | B.天平 | C.质谱 | D.核磁共振 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电解法促进橄榄石(主要成分是Mg2SiO4)固定CO2的部分工艺流程如下:
已知:Mg2SiO4(s) +4HCl(aq) 2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H =-49.04 kJ·mol-1
(1)某橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为 。
(2)固碳时主要反应的方程式为NaOH(aq)+CO2 (g)=NaHCO3 (aq),该反应能自发进行的原因是 。
(3)请在上图虚框内补充一步工业生产流程 。
(4)下列物质中也可用作“固碳”的是 。(填字母)
a.CaCl2 b.H2NCH2COONa c.(NH4)2CO3
(5)由图可知,90℃后曲线A溶解效率下降,分析其原因 。
(6)经分析,所得碱式碳酸镁产品中含有少量NaCl和Fe2O3。为提纯,可采取的措施依次为:对溶解后所得溶液进行除铁处理、对产品进行洗涤处理。判断产品洗净的操作是 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨水中滴加石蕊试液显蓝色 |
| B.NO2通入水中,气体由红棕色逐渐转变为无色 |
| C.向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
| D.向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.S | B.C | C.N | D.S和N |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.该反应的还原产物是I2 |
| B.每生成1molI2,转移的电子为2mol |
| C.氧化性:O3>I2 |
| D.在反应中H2O被氧化成O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com