
| 体系 | c(SO2)mol/L | c(O2)mol/L | c(SO3)mol/L | 反应方向 |
| (1) | 0.0600 | 0.400 | 2.00 | |
| (2) | 0.0960 | 0.300 | 0.500 | |
| (3) | 0.300 | 0.0400 | 1.44 |
 阅读快车系列答案
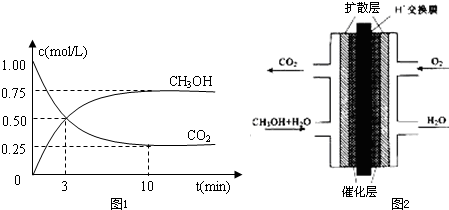
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 | B.4 | C.6 | D.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
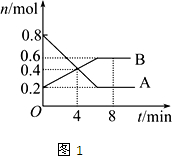
科目:高中化学 来源:不详 题型:填空题
| 一定条件 |
| n(CH3OH) |
| n(CO2) |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1mol3mol0mol |
| B.0mol0mol2mol |
| C.0.5mol1mol1mol |
| D.1mol3mol2mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨水应密闭保存,放置于低温处 |
| B.在硫酸亚铁溶液中,加入铁粉以防止氧化变质 |
| C.生产硝酸的过程中使用过量空气以提高氨气的利用率 |
| D.实验室常用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.③④ | D.①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com