
NA代表阿伏加德罗常数的值,下列有关叙述不正确的是
A.在熔融状态下,l mol Na2O2 完全电离出的离子数目为3 NA
B.将CO2通过Na2O2使固体质量增加mg,反应中转移的电子数mNA/14
C.在标准状况下,22.4LCH4与18 gH2O所含有的电子数均为10NA
D.含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为 NA
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
20℃时,H2S的饱和溶液1 L,浓度约0.1 mol·L-1,其电离方程式为:第一步:H2S
 H++HS-;第二步:HS-
H++HS-;第二步:HS-
 H++S2-,若使溶液中H+、S2-浓度同时减小,可采取的措施是( )
H++S2-,若使溶液中H+、S2-浓度同时减小,可采取的措施是( )
①加入适量NaOH固体 ②加入适量水 ③通入适量SO2 ④加入适量CuSO4固体
A.①④ B.②④ C.②③ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
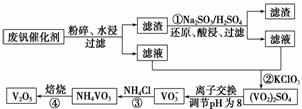
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式________________。
(2)图中所示滤液中含钒的主要成分为____________(写化学式)。
(3)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式为 VO
VO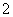 +
+ H2C2O4+
H2C2O4+ ________===
________=== VO2++
VO2++ CO2↑+
CO2↑+ H2O。
H2O。
(4)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO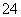 。电池放电时,负极的电极反应为V2+-e-===V3+。
。电池放电时,负极的电极反应为V2+-e-===V3+。
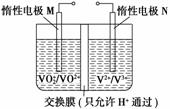
①电池放电时的总反应方程式为__________________。充电时,电极M应接电源的________极;
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+。则第一步反应过程中阴极区溶液n(H+)________(填“增大”、“不变”或“减小”),阳极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
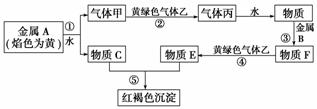
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A________、丙________。
(2)写出下列反应化学方程式:
反应①________________________________________________________________________;
反应⑤________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钾是一种重要的氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3、SiO2、Al2O3)为原料生产。实验室模拟工业法用铬铁矿制重铬酸钾(K2Cr2O7)的主要工艺如下:
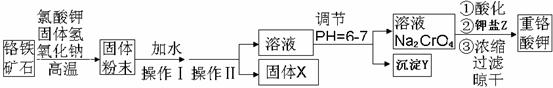
试回答下列问题:
(1)以上工艺流程所涉及元素中属于过渡元素的有 。铁在周期表的位置是 。
(2)操作Ⅱ的名称是 。
(3)固体X的主要成分是___________,沉淀Y的主要成分是 。
(4)流程中①酸化所用的酸和②钾盐Z最合适的是(填符号)________,
A.盐酸和氯化钾 B.硫酸和氯化钾 C.硫酸和硫酸钾 D.次氯酸和次氯酸钾
酸化反应的离子方程式为 。
(5)FeO·Cr2O3与氯酸钾、氢氧化钠高温反应化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3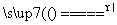 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%。工业上常通过下列反应制备CuCl:
2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4·5H2O与H2O的质量之比。
(2)准确称取所制备的0.250 0 g CuCl样品置于一定量的0.5 mol·L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce(SO4)2溶液。有关反应的离子方程式为
Fe3++CuCl===Fe2++Cu2++Cl-
Ce4++Fe2+===Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
查看答案和解析>>
科目:高中化学 来源: 题型:

去。经检测发现滤液中仍含有一定量的SO42—,其原因是
。【已知:Ksp(BaSO4)= 1.1 ×10—10 Ksp(BaCO3)= 5.1 ×10—9】
②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有 (填化学式),发生器中生成ClO2的化学方程式为 。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
 (D) +24NaClO3+12H2SO4=
(D) +24NaClO3+12H2SO4= ClO2↑+
ClO2↑+ CO2↑+18H2O+
CO2↑+18H2O+
(3)ClO2和Cl2均能将电镀废水中的CN—氧化为无毒的物质,自身被还原为Cl—。 处理含CN—相同时的电镀废水,所需Cl2的物质的量是ClO2的 倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com