考点:焓变和熵变,热化学方程式,化学电源新型电池,化学平衡的影响因素,物质的量或浓度随时间的变化曲线
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)依据反应和图象分析判断:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g),反应是熵减少的反应△S<0;反应物能量高于生成物的能量,判断反应是放热反应,△H<0;
(2)在体积为l L的密闭容器中,充入l mol CO
2和4mol H
2,一定条件下发生反应:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g),测得CO
2和CH
3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;①依据化学平衡三段式列式计算判断;②依据化学平衡常数的概念书写平衡常数计算式;③依据化学反应的影响因素和条件逐项分析判断;
A、反应是放热反应,升温平衡逆向进行;
B、将CH
3OH(g)及时液化抽出,减小生成物的量平衡正向进行;
C、选择高效催化剂只能改变速率,不改变化学平衡;
D、再充入l molCO
2和4molH
2,增大压强平衡正向进行;
(3)25℃,1.01×10
5Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,依据书写热化学方程式的方法写出该反应的热化学方程式为:CH
3OH(l)+
O
2(g)=CO
2(g)+2H
2O(l)△H=-738.4kJ?mol
-1;
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,原电池的负极失电子发生氧化反应,失电子的是甲醇,此电池的负极应加入或通入的物质有甲醇、氢氧化钠、水;负极的电极反应式结合化学方程式为2CH
3OH+3O
2+4KOH→2K
2CO
3+6H
2O;正极反应为O
2+2H
2O+4e
-=4OH
-;依据电子守恒,用化学方程式减去正极电极反应得到负极电极反应式.
解答:
解:(1)依据反应和图象分析判断:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g),反应是熵减少的反应△S<0;反应物能量高于生成物的能量,判断反应是放热反应,△H<0,
故答案为:C;
(2)在体积为l L的密闭容器中,充入l mol CO
2和4mol H
2,一定条件下发生反应:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g),测得CO
2和CH
3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;则①依据化学平衡列式计算为:
CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)
起始量(mol/L) 1 4 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 1.75 0.75 0.75
CO
2的平均反应速率v(CO
2)=
=0.075mol?L
-1?min
-1 ,故答案为:0.075 mol?L
-1?min
-1;
②该反应的平衡常数表达式K=
,故答案为:
;
③措施中能使化学平衡向正反应方向移动的是:
A、反应是放热反应,升温平衡逆向进行,故A错误;
B、将CH
3OH(g)及时液化抽出,减小生成物的量,平衡正向进行,故B正确;
C、选择高效催化剂只能改变速率,不改变化学平衡,故C错误;
D、再充入l molCO
2和4molH
2,增大压强平衡正向进行,故D正确;
故选BD;
(3)25℃,1.01×10
5Pa时,16g 液态甲醇物质的量为0.5mol,完全燃烧,当恢复到原状态时,放出369.2kJ的热量,依据书写热化学方程式的方法写出该反应的热化学方程式为:CH
3OH(l)+
O
2(g)=CO
2(g)+2H
2O(l)△H=-738.4 kJ?mol
-1,
故答案为:CH
3OH(l)+
O
2(g)=CO
2(g)+2H
2O(l)△H=-738.4kJ?mol
-1;
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,原电池的负极失电子发生氧化反应,失电子的是甲醇,此电池的负极应加入或通入的物质有甲醇、氢氧化钠、水;负极的电极反应式结合化学方程式为2CH
3OH+3O
2+4KOH→2K
2CO
3+6H
2O;正极反应为O
2+2H
2O+4e
-=4OH
-;依据电子守恒,用化学方程式减去正极电极反应得到负极电极反应式为:2CH
3OH+16OH
?-12e
-=2CO
32-+12H
2O,
故答案为:2CH
3OH+16OH
?-12e
-=2CO
32-+12H
2O;3O
2+6H
2O+12e
-=12OH
-.
点评:本题考查了反应的焓变判断,热化学方程式的书写原则,电极反应和电池反应的分析书写,化学平衡的影响因素判断平衡移动方向,化学平衡的计算的应用,图象分析是关键.综合性较大,难度中等.




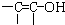 结构的物质)
结构的物质)