
 .
. .
. .
.
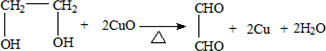
分析 (1)醇氧化为醛的条件是铜做催化剂加热;水浴加热优点:受热均匀,可以得到平稳的乙二醇蒸汽;
(2)按甲装置进行实验,B管处装铜粉,则通入A管的X气体为空气或氧气,目的是为了生成氧化铜催化氧化乙二醇生成乙二醛;
(3)按乙装置进行实验无空气或氧气通入,而氧化铜在加热条件下能够氧化乙二醇生成乙二醛;
(4)乙二醛含有醛基,能够被银氨溶液氧化生成单质银、羧酸铵、氨气和水,依据醛基氧化实质写出化学方程式;
解答 解:(1)乙二醇氧化为乙二醛的条件是铜做催化剂加热,可以用酒精灯加热;乙二醇沸点低,加热可以促进乙二醇挥发,用水浴加热,液体受热均匀,产生的乙二醇蒸汽平稳均匀;
故答案为:酒精灯;产生的气流平稳均匀;
(2)按甲装置进行实验,B管处装铜粉,则通入A管的X气体为空气或氧气,目的是为了生成氧化铜催化氧化乙二醇,反应的化学方程式为: ,
,
故答案为:空气或氧气; ;
;
(3)按乙装置进行实验无空气或氧气通入,而氧化铜在加热条件下能够氧化乙二醇生成乙二醛,所以B管中为氧化铜,反应的化学方程式: ,
,
故答案为:氧化铜; ;
;
(4)乙二醛含有醛基,能够被银氨溶液氧化生成单质银、羧酸铵、氨气和水,化学方程式: ,
,
故答案为: .
.
点评 本题通过乙二醛的制备,考查了乙二醇、乙二醛的性质,有机化学方程式的书写,熟悉有机物的结构特点是解题关键,注意醇催化氧化反应的原理,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入过量氨水 | B. | Al2(SO4)3溶液中加入过量KOH溶液 | ||
| C. | MgCl2溶液中加入过量氨水 | D. | MgSO4溶液中加入过量KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 滴定次数实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用含0.lmolFeCl3的溶液与足量沸水反应制得的Fe(0H)3胶体中胶粒数为0.1NA | |
| B. | 46g N02和N204的混合气体中含原子总数为NA | |
| C. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| D. | 0.25 mol Na2O2中含有的阴离子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都可用于食品调味 | |
| B. | 可以用食醋出去水壶中的水垢(以CaCO3为主) | |
| C. | 乙醇和乙酸都能发生氧化反应 | |
| D. | 酸雨是pH小于7的雨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | II A | IIIA | IVA | VA | VIA | VⅡA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
 或
或 等.
等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com