
| A.Na | B.Mg | C.Fe | D.Al |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.①② | B.③④ | C.②④ | D.⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.9g18O2含有的中子数为5NA |
| B.标准状况下,0.5NABr2所占的体积约为11.2L |
| C.常温下,1L0.1mol·L-1NH4NO3溶液中含有的NH4+数为0.1NA |
| D.一定条件下,lmol N2和3mol H2在密闭容器充分反应,生成N-H键的数目为6NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA |
| B.78 g苯含有CC双键的数目为3NA |
| C.常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA |
| D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所得溶液的物质的量浓度:c=1 mol·L-1 |
| B.所得溶液中含有NA个HCl分子 |
| C.36.5 g HCl气体占有的体积为22.4 L |
| D.所得溶液的质量分数:W=36.5 c/(1 000ρ) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.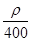 mol·L-1 mol·L-1 | B.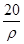 mol·L-1 mol·L-1 |
C.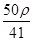 mol·L-1 mol·L-1 | D.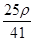 mol·L-1 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.8.96 L | B.6.72 L | C.4.48 L | D.2.24 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 (4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
(4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com