
【题目】K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体的原料,以硫酸工业的尾气为原料联合制备K2SO4和Mn3O4的工艺流程如图所示。回答下列问题:

(1)Mn3O4中的Mn元素有+2价和+3价两种情况,则 Mn3O4中+2价与+3价Mn 元素的物质的量之比为__________________________。
(2)“反应I”________(填“是”或“不是”)氧化还原反应,为提高反应的反应速率,可采取的措施有____________________________(答出一条即可)。
(3)“反应II”的反应原理是___________________________。
(4)试剂a的电子式为_________________________。
(5)“一系列操作”指____________________,该过程用到的非玻璃仪器为_______________。
(6)流程图中“煅烧”操作的温度与剩余固体质量变化曲线如图所示。

则产物A的化学式为______________,产物B的化学式为__________。
【答案】 1:2 是 采用CaCO3粉末(或适当增大反应温度,合理即可) 微溶的 CaSO4 转化为难溶的CaCO3 ![]() 蒸发浓缩,冷却结晶,过滤 蒸发皿 MnSO4 Mn3O4
蒸发浓缩,冷却结晶,过滤 蒸发皿 MnSO4 Mn3O4
【解析】分析:硫酸工业的尾气中含有二氧化硫,反应Ⅰ是用碳酸钙、二氧化硫反应生成亚硫酸钙,再被空气中的氧气氧化成硫酸钙,反应Ⅱ为硫酸钙中加入碳酸氢铵和氨气,生成碳酸钙沉淀和硫酸铵,反应Ⅲ向硫酸铵溶液中加入KCl溶液充分反应后,进行蒸发浓缩、趁热过滤、洗涤、干燥等操作即得K2SO4产品,反应Ⅳ为二氧化锰氧化二氧化硫得硫酸锰,经除杂结晶得硫酸锰晶体,再经加热可得Mn3O4,据此解答。
详解:(1)Mn3O4中的Mn元素有+2价和+3价两种情况,设Mn3O4中+2价与+3价Mn的个数分别是x、y,则根据原子守恒和正负价代数和为0可知x+y=3、2x+3y=2×4,解得x=1、y=2,则Mn3O4中+2价与+3价Mn元素的物质的量之比为1:2。
(2)亚硫酸钙易被氧化,则“反应I”是氧化还原反应;根据外界条件对反应速率的影响可知为提高反应的反应速率,可采取的措施有采用CaCO3粉末或适当增大反应温度。
(3)硫酸钙微溶,碳酸钙难溶,因此“反应II”的反应原理是微溶的CaSO4转化为难溶的CaCO3。
(4)根据原子守恒可知试剂a是氯化钾,含有离子键,电子式为![]() 。
。
(5)“一系列操作”是指从溶液中得到晶体,操作为蒸发浓缩,冷却结晶,过滤,该过程用到的非玻璃仪器主要为蒸发皿。
(6)MnSO4H2O受热分解,先失去结晶水。设MnSO4H2O的物质的量为1 mol,质量为169g,其中含有m(MnSO4)=151g,根据题意可知,在A处固体的质量为169g×89.35/100=151g,所以A的组成为MnSO4;在B处固体的质量为169g×45.17/100=76.33g,其中Mn是55g,O是21.33g,则二者的个数之比是1:21.33/16=3:4,因此化学式为Mn3O4。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】盐酸氯丙嗪也叫冬眠灵,是第一个抗精神病药,开创了药物治疗精神疾病的历史,某研究小组利用下列途径合成盐酸氯丙嗪。

已知: 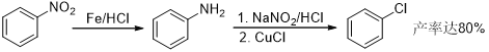
请回答:
(1) B中含有官能团名称为__________________;
(2) 下列说法不正确的是____________;
A. 化合物B可以发生加成反应
B. 化合物D在一定条件下既可与酸反应,又可以与碱反应
C. 合成路线中属于取代反应的为(1) (3) (4) (6)
D. 反应(7)是为了提高氯丙嗪的水溶性
(3) 写出E→F的化学反应方程式________________________________________________。
(4) 该研究小组在实验中发现,苯环上直接用Cl2取代的产率一般不到10%,请你设计合理步骤,利用甲苯为原料,合成化合物C________。(注:苯甲酸的苯环上发生取代反应时,取代主要发生在羧基的间位)
(5) 请写出符合下列条件的所有E的同分异构体________。
a. 分子中含有一个萘环![]() ,且为萘的邻位二取代物(邻位不包括
,且为萘的邻位二取代物(邻位不包括 );
);
b. 分子中有一个五元环;
c. 1H-NMR显示分子中有8种氢。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向[H+]=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中[H+]=1×10-3mol·L-1。下列对该溶液的叙述不正确的是( )
A. 该温度高于25 ℃
B. 所得溶液中,由水电离出来的H+的浓度为1×10-11mol·L-1
C. 加入NaHSO4晶体抑制水的电离
D. 该温度下,此NaHSO4溶液与某pH=11的Ba(OH)2溶液混合后溶液呈中性,则消耗的NaHSO4溶液与Ba(OH)2溶液的体积比为100:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)基态铜原子价电子排布式为____________;第二电离能I(Cu)________I (Zn)(填“>”或“<”)。
(2)四氟硼酸四(乙腈)合铜(Ⅰ)配合物是有机合成中常见催化剂,其化学式为[Cu (CH3CN) 4]BF4。
①该配合物中阴离子的空间构型为_____________,与其互为等电子体的分子或离子是______________(各举1例)。
②配体分子中与Cu(I) 形成配位键的原子为____________;配体CH3CN 中的碳原子杂化方式是______。
(3)已知Cu2O 熔点为1235 ℃,K2O 熔点为770℃,Cu2O 属于____晶体,前者熔点较高,其原因是_______________________________________。
(4)Cu3N 的晶胞(立方)结构如下图所示:

①距离最近的两个Cu+间的距离为________nm;
②Cu3N 晶体的密度为_____________ g·cm-3(列出计算式,不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t ℃时AgCl的Ksp=4×10-10,在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )

A. 在t ℃时,Ag2CrO4的Ksp为1×10-11
B. 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点
C. 在t ℃,Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)平衡常数K=6.25×107
(aq)平衡常数K=6.25×107
D. 在t ℃时,以0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是( )
A. 金属钠与水反应:Na +2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
B. 用氢氧化钡溶液中和硫酸溶液:Ba2++OH-+H++SO42-![]() H2O+BaSO4↓
H2O+BaSO4↓
C. 氯化铝溶液中加入过量的氨水:Al3++ 4NH3·H2O ![]() AlO2- + 4NH4++ 2H2O
AlO2- + 4NH4++ 2H2O
D. 在澄清石灰水中通入过量的CO2:OH-+CO2![]() HCO3-
HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某碳酸钠和碳酸氢钠的混合物2.74g加热到质量不再变化时,剩余物质的质量为2.12g。
(1)求混合物中碳酸钠的质量分数?
(2)标准状况下生成CO2气体的体积?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从含镍电镀废渣(除含镍外,还含有Cu、Zn、Fe等杂质)中制备NiCO3的工艺流程如下。

(1)“酸化”时需将电镀废渣粉碎并适当加热,原因是________________________。
(2)“氧化”时需要控制温度不超过40℃,其目的是________________________;“沉铁”后所得滤液中c(Fe3+)=____________mol·L-1[该温度下 Fe(OH))3的Ksp=2.64×10-39]。
(3)Fe2+也可以用NaCO3氧化,一定条件下可生成黄铁矾钠[Na2Fe6(SO4) 4(OH)12沉淀而被除去;如图是pH-温度关系图,图中阴影部分为黄铁矾钠稳定存在区域。

①FeOOH中铁的化合价是____________价。.
②酸性条件下,ClO3ˉ恰好氧化Fe2+时,氧化剂与还原剂物质的量之比是____________。
③根据上图,当T=120℃、pH=4时Fe元素的存在形式是____________(填化学式),该温度下,若要制得黄铁矾钠需控制pH范围____________(填字母选项)。
a.0~1 b.1~2.5 c.2.5~4
(4)已知SOCl2能与水反应生成SO2和HCl。写出NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水制无水NCl2的化学方程式____________________________________。NCl2·6H2O需在亚硫酰氯(SOCl2)中加热脱水的原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=160mL时,则V2为

A.240mL B.300mL C.400mL D.440mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com