
| 原子 | a | b | c | d | e | f | g |
| L层电子数 | 4 | 5 | 6 | ||||
| M层电子数 | 1 | 2 | 3 | 7 |
| A. | a和g | B. | b和f | C. | d和f | D. | c和g |
分析 由元素核外电子排布可知a、b、c、d、e、f、g分别为Na、Mg、Al、C、N、O、Cl等元素,元素的原子间反应容易形成共价键,一般为活泼非金属元素,以此解答.
解答 解:由元素核外电子排布可知a、b、c、d、e、f、g分别为Na、Mg、Al、C、N、O、Cl等元素,
A.Na和Cl形成NaCl,为离子化合物,含有离子键,故A错误;
B.生成MgO,为离子化合物,含有离子键,故B错误;
C.生成CO2,为共价化合物,含有共价键,故C正确;
D.生成AlCl3,为共价化合物,含有共价键,故D正确.
故选CD.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意元素种类的判断,把握核外电子排布特点,题目难度不大.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:填空题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ⑬ | |||||||
| 2 | ① | ⑭ | ② | |||||
| 3 | ③ | ④ | ⑥ | ⑤ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
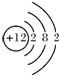 ,⑥
,⑥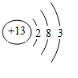 ,⑧
,⑧ .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液除去CO2中混有的HCl气体 | |
| B. | 加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质 | |
| C. | 所有不锈钢都只含有金属元素 | |
| D. | 用乙醇从碘水中萃取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与$\underset{\stackrel{16}{\;}}{8}{O}_{2}$互为同位素 | B. | 与氧气具有相同的化学性质 | ||
| C. | 与氧气互为同素异形体 | D. | 与同质量的氧气具有相同的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
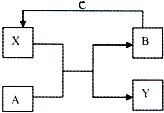 A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )
A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )| A. | 若X是光导纤维的主要成分,工业上常利用反应I制备B,Y的化学式为CO | |
| B. | 若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为Fe3O4+8H++2I-=3Fe 2++I2+4H2O | |
| C. | 若组成A的元素在短周期中原子半径最大(稀有气体除外),以Y为电解质溶液,气体B为燃料,C为氧化剂可构成燃料电池,工作一段时间后,Y溶液的pH增大 | |
| D. | 若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应X检验氯气管道是否漏气,Y的电子式为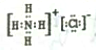 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2LO2和03组成的混合气体含有原子数为NA | |
| B. | 常温常压下,1.7gNH3含有的电子数目为NA | |
| C. | .0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA | |
| D. | 标准状况下,22.4LNO2与足量的H2O充分反应后转移电子数为NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
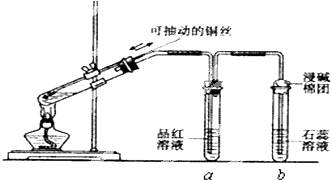
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com