
 C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
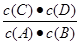 =
=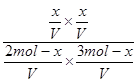 =1,解得x=1.2mol。B的转化率为0.4。
=1,解得x=1.2mol。B的转化率为0.4。

 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:不详 题型:填空题
 H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有
H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有 查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
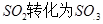 是一个关键的步骤。
是一个关键的步骤。 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。 mol
mol ,发生反应:
,发生反应: ,达平衡后改变下述条件,
,达平衡后改变下述条件, 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。A.保持温度和容器体积不变,充入2mol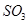 |
| B.保持温度和容器体积不变,充入2molN2 |
C.保持温度和容器内压强不变,充入1mol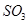 |
| D.移动活塞压缩气体 |
 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。
 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。 查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
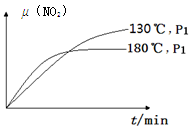
 N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:| 实验编号 | 温度 | 时间 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |
 4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是
WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是| A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W,W重新沉积到灯丝上 |
| B.灯丝附近温度越高,WI2(g)的转化率越低 |
C.该反应的平衡常数表达式是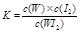 |
| D.利用该反应原理可以提纯钨 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
B.25℃时反应Ni(CO)4(g)  Ni(s)+4CO(g)的平衡常数为0.5(mol·L-1)3 Ni(s)+4CO(g)的平衡常数为0.5(mol·L-1)3 |
| C.在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5mol/L,则此时温度高于80℃ |
| D.80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,再次达到平衡后CO的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
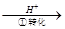 Cr2O72-
Cr2O72-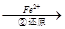 Cr3+
Cr3+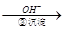 Cr(OH)3↓
Cr(OH)3↓ 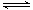 Cr2O72- (橙色)+H2O
Cr2O72- (橙色)+H2O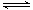 Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L下列判断错误的是 ( )
zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L下列判断错误的是 ( ) | A.x+y>z | B.平衡向正方向移动 |
| C.B的转化率降低 | D.C的体积分数下降 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g),5 min后达到平衡。已知各物质的平衡浓度关系为
C(g)+D(g),5 min后达到平衡。已知各物质的平衡浓度关系为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com