
| 反应过程 | 化学方程式 | 不同温度下的K | ||
| 273.15K | 1000K | |||
| Ⅰ | 二甲醚羰基化反应 | CH3OCH3(g)+CO(g)?CH3COOCH3(g) | 1016.25 | 101.58 |
| Ⅱ | 乙酸甲酯加氢反应 | CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g) | 103.97 | 10-0.35 |
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| CH3OCH3(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
| CO(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
| CH3COOCH3(g) | 0 | 0.20 | 0.30 | 1.00 | 1.50 | 1.50 |

分析 (1)二甲醚羰基化反应为CH3OCH3(g)+CO(g)?CH3COOCH3(g),根据表中数据可知,温度从273.15K升高到1000K,该反应的平衡常数从1016.25变为101.58,升高温度后平衡常数减小,则升高温度平衡向着逆向移动,据此判断该反应的焓变;
(2)CH3OCH3(g)+CO(g)+2H2 (g)?CH3OH(g)+C2H5OH(g),反应为气体体积减小的放热反应,可逆反应达到平衡状态时,各物质的物质的量、物质的量浓度及各物质成分都不变,以及由此引起的一系列物理量不变;
(3)平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,反应为放热反应,升温平衡逆向进行;
(4)图象分析可知乙酸甲酯含量在300K~600K范围内,随温度升高增大,反应Ⅰ的转化率增大,反应Ⅱ的转化率小;
(5)①CH3OCH3(g)+CO(g)?CH3COOCH3(g)△H<0,20min时到30min,CH3OCH3(g)和CO(g)物质的量难度减小0.7mol/L,生成的CH3COOCH3(g)物质的量难度增加0.7mool/L,和10min-20min内反应的变化可知反应速率增加,但反应比例关系符合化学方程式计量数之比,说明是加入了催化剂;
②图表中数据可知,20min后反应速率增大,是加入了催化剂,图象中变化快,40min反应达到平衡状态,此时乙酸甲酯体积含量=$\frac{1.5}{0.5+0.5+1.5}$×100%=60%,40min后含量不再发生变化,据此画出图象.
解答 解:(1)根据表中数据可知,温度从273.15K升高到1000K,反应CH3OCH3(g)+CO(g)?CH3COOCH3(g)的平衡常数从1016.25变为101.58,升高温度平衡常数减小,则升高温度平衡向着逆向移动,说明逆反应为吸热反应,则正反应为放热反应,所以该反应的焓变△H<0,
故答案为:<;
(2)CH3OCH3(g)+CO(g)+2H2 (g)?CH3OH(g)+C2H5OH(g),反应为气体体积减小的放热反应,
A.速率之比等于化学方程式计量数之比,2v(CH3COOCH3)=v(H2)为正反应速率之比,不能证明反应达到平衡状态,故A错误;
B.反应前后气体体积减小的放热反应,密闭容器中总压强不变说明物质的物质的量不变,说明反应达到平衡状态,故B正确;
C.气体质量和体积不变,密闭容器中混合气体的密度保持不变不能说明反应达到平衡状态,故C错误;
D.密闭容器中C2H5OH的体积分数保持不变说明反应达到平衡,故D正确;
故答案为:BD;
(3)CH3OCH3(g)+CO(g)+2H2 (g)?CH3OH(g)+C2H5OH(g)的平衡常数表达式K=$\frac{c({C}_{2}{H}_{5}OH)c(C{H}_{3}OH)}{c(C{H}_{3}OC{H}_{3})c(CO){c}^{2}({H}_{2})}$,反应为放热反应,随温度的升高,平衡逆向进行,总反应的K减小,
故答案为:$\frac{c({C}_{2}{H}_{5}OH)c(C{H}_{3}OH)}{c(C{H}_{3}OC{H}_{3})c(CO){c}^{2}({H}_{2})}$;减小;
(4)观察图2可知乙酸甲酯含量在 300K~600K范围内发生变化是随温度升高而增大,该温度范围,反应Ⅰ转化率都很大,反应Ⅱ的转化率随温度升高而减小,所以乙酸甲酯的含量升高,
故答案为:随温度升高而增大;该温度范围,反应Ⅰ转化率都很大,反应Ⅱ的转化率随温度升高而减小,所以乙酸甲酯的含量升高;
(5)①CH3OCH3(g)+CO(g)?CH3COOCH3(g)△H<0,20min时到30min,CH3OCH3(g)和CO(g)物质的量难度减小0.7mol/L,生成的CH3COOCH3(g)物质的量难度增加0.7mool/L,和10min-20min内反应的变化可知,转化率与20min时到30min的转化率相同,反应速率增加,反应比例关系符合化学方程式计量数之比,反应物的转化率未变,说明是加入了催化剂,
A.通入一定量的CO 会提高 CH3OCH3(g)的转化率,CO转化率减小,不符合表中数据变化,故A错误;
B.移出一定量的CH3OCH3 会提高,故B错误;
C.加入合适的催化剂会提高反应速率,不改变反应物的转化率,故C正确;
故答案为:C;
②图表中数据可知,20min后反应速率增大,是加入了催化剂,图象中变化快,40min反应达到平衡状态,此时乙酸甲酯体积含量=$\frac{1.5}{0.5+0.5+1.5}$×100%=60%,40min后含量不再发生变化,画出的图象为: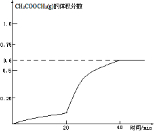 ,
,
故答案为: .
.
点评 本题考查了反应热与焓变的关系、化学平衡影响因素、平衡常数计算、平衡状态的建立等,题目难度中等,明确化学反应与能量变化的关系为解答关键,注意掌握吸热反应、放热反应与焓变之间关系,试题培养了学生的分析能力及灵活应用基础知识的能力


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
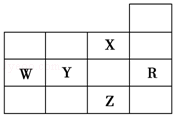 如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | W元素的电负性大于Y元素的电负性 | |
| B. | X元素是电负性最大的元素 | |
| C. | p能级未成对电子最多的是Z元素 | |
| D. | Y、Z的阴离子电子层结构都与R原子的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁铝矾有净水作用,其水溶液显中性 | |
| B. | 向该溶液中加入Na2S溶液,有淡黄色沉淀 | |
| C. | 用惰性电极电解该溶液时,阴极区有沉淀 | |
| D. | 在空气中,蒸干并灼烧该溶液,最后所得的残留固体为Al2O3、Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱式滴定管用蒸馏水洗涤之后装入KOH标准溶液,并读数 | |
| B. | 选择酚酞作指示剂,终点时溶液由无色刚好变成粉红色且半分钟不褪色 | |
| C. | 锥形瓶中从滴定开始到滴定终点时,水电离的c(H+)由小逐渐增大 | |
| D. | 滴定终点时,发现滴定管尖嘴处有气泡,则测定结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
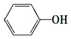 苯酚具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的
苯酚具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的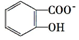
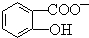 中形成分子内氢键,使其更难电离出H+.
中形成分子内氢键,使其更难电离出H+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com