
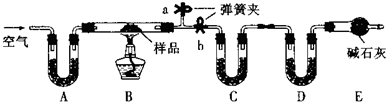
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:

| LiBH4 |
| THF |
| LiBH4 |
| THF |
| CH3I |
| 催化剂 |
| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液:Al3+、K+、Cl-、S2- |
| B、滴加酚酞显红色的溶液:Na+、ClO-、NO3-、Cl- |
| C、滴加甲基橙显红色的溶液:Fe2+、NH4+、SO42-、NO3- |
| D、c(H+)=c(OH-)的溶液:Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
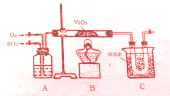 某研究性学习小组为在实验室再现二氧化硫催化氧化的过程,应制取少量二氧化硫晶体,设计了如下图所示装置,已知三氧化硫通水生成硫酸并放出大量热,容易形成酸液,试回答:
某研究性学习小组为在实验室再现二氧化硫催化氧化的过程,应制取少量二氧化硫晶体,设计了如下图所示装置,已知三氧化硫通水生成硫酸并放出大量热,容易形成酸液,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | L层上有2对未成对电子 |
| X | 最外层电子数是次外层电子数的3倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | 向FeCl2溶液中滴入氯水 2Fe2++Cl2=2Fe3++2Cl- | 向FeCl2溶液中滴入碘水 2Fe2++I2=2Fe3++2I- |
| B | 向澄清石灰水中通入少量CO2 气体 Ca2++2OH-+CO2=CaCO3↓+H2O | 向澄清石灰水中通入少量SO2 气体 Ca2++2OH-+SO2=CaSO3↓+H2O |
| C | 向Na2CO3溶液中滴入稀HNO3 CO32-+2H+=CO2↑+H2O | 向Na2SO3溶液中滴入稀HNO3 SO32-+2H+=SO2↑+H2O |
| D | CO2通入漂白粉溶液中 CO2+Ca2++2ClO-+H2O=CaCO3↓+2HClO | SO2通入漂白粉溶液中 SO2+Ca2++2ClO-+H2O=CaSO3↓+2HClO |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
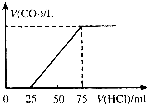 有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.1 mol |
| B、0.87 mol |
| C、0.8 mol |
| D、0.5 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com