
【题目】铬是由法国化学家沃克兰于1798年在巴黎发现的。目前铬被广泛应用于冶金、化工、铸铁、耐火及高精端科技等领域。
(1)铬元素基态原子的电子排布式为____________,其核外未成对电子数为__________。
(2)金属铬的第二电离能(ICr)和锰的第二电离能(IMn)分别为1590.6kJ·mol-1、1509.0 kJ·mol-1,ICr>IMn的原因是__________。
(3)雷氏盐(Reinecke salt)的化学式为NH4[Cr(NCS)4(NH3)2].H2O是一种易溶于水和乙醇的暗红色固体。
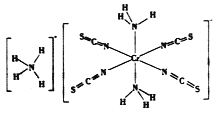
①雷氏盐中铬元素的化合价为_______,NH3与铬离子形成的化学键为__________。
②NCS-的立体构型是________,其中碳原子的杂化轨道类型为_______。SO2、CO2、BaCl2、SCl2四种分子中,与NCS-互为等电子体的是_____________。
③乙醇的沸点比溴乙烷高,其原因是__________。
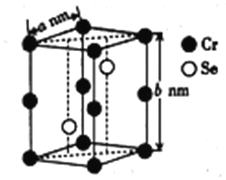
(4)硒化铬的晶胞结构如图所示,晶胞参数为anm和bnm,则硒化铬的密度为____________g·cm-3(列出表达式即可)。
【答案】 1s22s22p63s23p63d54s1(或[Ar]3d54s1) 6 铬的第二电离能是失去半充满3d5上的电子,锰的第二电离能是失去3d6上的电子变为半充满状态 +3 配位键 直线形 sp CO2、BeCl2 乙醇分子间形成氢键 ![]() (或
(或![]() )
)
【解析】(1). 铬元素是24号元素,其价电子排布非常特别,基态原子的电子排布式为1s22s22p63s23p63d54s1(或[Ar]3d54s1),其3d和4s都是半充满状态,3d轨道的5个电子分占5个轨道并且自旋状态相同,这样排布体系能量较低,其核外未成对电子数为6(3d5个、4s1个)。
(2). 金属铬失去第1个电子后,外围电子结构为3d5,3d轨道处于较稳定的半充满状态,而锰失去第1个电子后外围电子结构为3d54s1,4s轨道的电子能量较低容易失去,失去后变为半充满状态,所以铬的第二电离能高于锰。答案:ICr>IMn的原因是铬的第二电离能是失去半充满3d5上的电子,锰的第二电离能是失去3d6上的电子变为半充满状态。
(3). 由雷氏盐(Reinecke salt)的化学式NH4[Cr(NCS)4(NH3)2].H2O可知,它是一种配合物,其外界是一个铵根NH4+,带一个单位的正电荷,所以其内界必然带一个单位的负电荷,内界有两种配体,分别是氨分子和硫氰根离子,氨分子不带电荷,硫氰根离子带一个单位的负电荷,所以中心原子铬带3个单位的正电荷,铬的化合价是+3。①雷氏盐中铬元素的化合价为+3,NH3与铬离子形成的化学键为配位键或共价键。②由雷氏盐的结构式可知,NCS-的中心原子C原子形成了两个双键,每个双键含一个σ键和一个π键,所以NCS-的立体构型是直线形,其中碳原子的杂化轨道类型为sp 杂化。NCS-中有3个原子,价电子数是16,所以SO2、CO2、BaCl2、SCl2四种分子中,与NCS-互为等电子体的是CO2、BeCl2。
③乙醇和溴乙烷都是分子晶体,它们的分子间都有范德化力,但是乙醇分子间还能形成氢键,氢键是比范德化力更强的分子间作用力,所以乙醇的沸点比溴乙烷高,其原因是乙醇分子间形成氢键。
(4). 由硒化铬的晶胞结构可求出每个晶胞中有2个铬原子和2个硒原子。由晶胞参数为anm和bnm可算出每个晶胞的体积为a2b nm3即a2b ![]() 10-21cm3,硒化铬的摩尔质量为131g/mol,取1mol硒化铬的晶胞来计算它的密度,1mol晶胞中有2molCrSe,则其质量为262g,体积为NAa2b
10-21cm3,硒化铬的摩尔质量为131g/mol,取1mol硒化铬的晶胞来计算它的密度,1mol晶胞中有2molCrSe,则其质量为262g,体积为NAa2b ![]() 10-21cm3,则硒化铬的密度为
10-21cm3,则硒化铬的密度为![]() g·cm-3
g·cm-3


科目:高中化学 来源: 题型:
【题目】溴酸银(AgBrO3)溶解度随温度变化曲线如图所示。下列说法正确的是
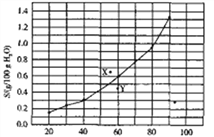
A. 溴酸银的溶解是一个熵增、焓减过程
B. 对应温度下,X点的分散系中,V(溶解)>v(沉淀)
C. Y点的分散系中,c(Ag+)·c(BrO3-)>6.25×10-4
D. 60 ℃时溴酸银饱和溶液中c(BrO3-)=0.025mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下2AB(g) ![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成n mol A2,同时消耗2n mol AB
B.容器内三种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列各组离子在指定溶液中一定能大量共存的是
A. pH=1的溶液中:Na+、K+、MnO4-、CO32-
B. c(H+)=1×10-13 mol·L-1的溶液中:Mg2+、Cu2+、SO42-、NO3-
C. 0.1 mol·L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl-
D. 0.1 mol·L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做如下探究实验。
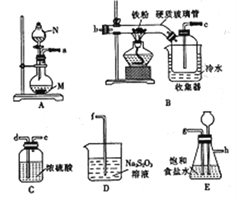
已知:①无水氯化铁在空气中易潮解,加热易升华;
②工业上,向500~600 ℃的铁屑中通人氯气可生产无水氯化铁;
③向炽热的铁屑中通入氯化氢可以生产无水氯化亚铁和氢气,
(1)仪器N的名称是____________, N中盛有浓盐酸,烧瓶M中的固体试剂___________(填化学式)。
(2)装置的连接顺序为_______→ → → → → → →d→e→f。(用小写字母表示,部分装置可以重复使用)
(3)若缺少装置E,则对本实验造成的影响是___________________________。
(4)已知硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氯剂,反应后Na2S2O3被氧化为Na2SO4,则装置D中
发生反应的离子方称式为_________________________。
(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质 一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
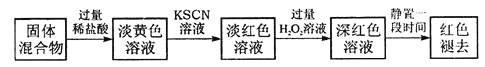
①淡红色溶液中加入过量H2O2溶液后,溶液红色加深的原因是__________________(用离子方程式表示)。
②已知红色褪去的同时有气体生成,经检验气体为O2。该小组对红色褪去的原因进行探究。
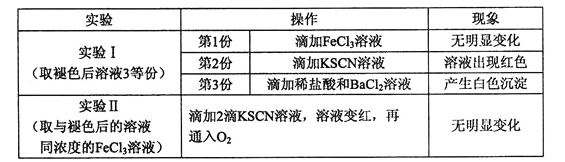
由实验Ⅰ和Ⅱ可得出的结论为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A.CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-用热的纯碱溶液清洗油污
+OH-用热的纯碱溶液清洗油污
B.SnCl2+H2O![]() Sn(OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠
C.TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl制备TiO2纳米粉
TiO2·xH2O↓+4HCl制备TiO2纳米粉
D.Al3++3H2O![]() Al(OH)3(胶体)+3H+明矾净水
Al(OH)3(胶体)+3H+明矾净水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬酸钾(K2CrO4)为原料用电化学法制备K2Cr2O7的装置如图,下列说法正确的是
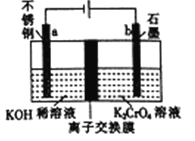
A. a极的电极反应为:2H2O+2e-=2OH-+H2↑
B. 电解过程中氢氧化钾溶液的浓度保持不变
C. b极上CrO42-发生氧化反应生成Cr2O72-
D. 电解过程中H+从右侧通过离子交换膜迁移到左侧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用工艺如下:
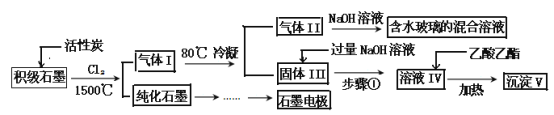
(注:SiCl4的沸点是57.6C,金属氯化物的沸点均高于150C)
(1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是 。
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为 。由气体II中某物质得到水玻璃的化学方程式为 。
(3)步骤①为:搅拌、 。所得溶液IV中阴离子有 。
(4)由溶液IV生成沉淀V的总反应的离子方程式为 。100kg初级石墨最多可获得V的质量为 kg。
(5)石墨可用于自然水体中铜件的电化学防腐,完成图防腐示意图,并作相应标注。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com