
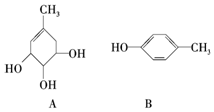
 A、B的结构简式如图:
A、B的结构简式如图:分析 (1)A中含有官能团是碳碳双键和醇羟基;B中官能团是酚羟基;
(2)卤代烃、酚、羧酸、酯都能和NaOH溶液反应;
(3)A发生消去反应可以得到B,需要浓硫酸作催化剂、加热条件;
(4)A中只有碳碳双键能和溴发生加成反应,B中苯环上酚羟基邻对位氢原子能和溴发生取代反应.
解答 解:(1)A中含有官能团是碳碳双键和醇羟基;B中官能团是酚羟基,
故答案为:(醇)羟基、碳碳双键;(酚)羟基;
(2)卤代烃、酚、羧酸、酯都能和NaOH溶液反应,A中不含卤原子、酚羟基、羧基、酯基,所以不能和NaOH溶液反应,B中含有酚羟基能和NaOH反应,故答案为:不能;能;
(3)A发生消去反应可以得到B,需要浓硫酸作催化剂、加热条件;
故答案为:消去反应; 浓硫酸、加热;
(4)A中只有碳碳双键能和溴发生加成反应,B中苯环上酚羟基邻对位氢原子能和溴发生取代反应,所以A能与1mol溴反应,B能和2mol溴发生取代反应,故答案为:1;2.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,注意A中不含酚羟基,为易错点.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑤ | C. | ③④⑤⑥ | D. | ④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和反应时并不一定都伴随着能量变化 | |
| B. | 所有的燃烧反应都是放热反应 | |
| C. | 只要有能量变化的都是化学变化 | |
| D. | 任何反应中的能量变化都表现为热量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 220 | 330 | 440 | 550 | 660 | 770 | 880 |
| 铜平均溶解速率(×10-3mol•L-1•min-1) | 77.34 | 88.01 | 99.25 | 77.98 | 77.24 | 66.73 | 55.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com