
1. 52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀
52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀 ,下列说法不正确的是
,下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2 ︰1
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C.NO2和N2O4 的混合气体中,NO2 的体积分数是80%
D.得到2.54沉淀时,加入NaOH溶液的体积是600mL
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
塑料制品废弃物会严重污染环境,俗称为“白色污染”,为了防止这种污染,有一条途径是将合成的高分
子化合物重新变成小分子化合物。目前对结构为 
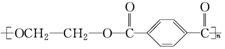 的高分子材料已成功
的高分子材料已成功
地实现上述处理。试分析若用CH3OH来处理它,下列物质中不能得到的有机物是( )
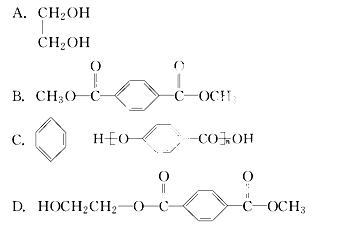
查看答案和解析>>
科目:高中化学 来源: 题型:
掌握物质之间的转化,是学习元素化合物知识的基础。
(I)(1)中学常见的某反应的化学方程式为:
A+B→C+D+H2O(未配平,反应条件略去)。
若C、D均为气体,且都能使澄清石灰水变浑浊。
①请写出该反应的化学方程式____________;
②某探究性学习小组利用右图中所列装置实验,证明上述反应中有C、D生成。则b瓶溶液的作用是_________,该溶液还可以用_____________试剂代替。
③装置d中所盛溶液是__________。
(II)下列框图所示的物质转化关系中,甲、乙、丙是常见的气体单质。气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略
 去)。
去)。
请回答下列问题:
(1)写出C的电子式:___________________________。
(2)E是_______化合物(填“共价”或“离子”,含有的化学键为__________________。
(3)写出B和丙生成A的离子反应方程式_________________________________________。
(4)工业上可用C的浓溶液吸收某些工厂尾气中的SO2,写出反应成酸式盐的离子方程式:
______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2FeO4是一种高效多功能水处理剂,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2 O2===2Na2FeO4+2Na2O+2
O2===2Na2FeO4+2Na2O+2 +O2↑。下列对此反应的说法中,不正确的是 ( )
+O2↑。下列对此反应的说法中,不正确的是 ( )
A.方框中的物质为Na2SO4
B.Na2O2既是氧化剂,又是还原剂
C.Na2FeO4既是氧化产物,又是还原产物
D.2 mol FeSO4发生反应时,反应中共转移8 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
向FeCl2和FeCl3混合溶液中加入适量KOH,高速搅拌下加入油脂,过滤后干燥得到一类特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3)。请回答下列问题:
(1)若x的平均值为1.3,则磁流体中Fe2+和Fe3+的质量之比为 。
(2)若x为1.4,请写出该磁流体在稀硫酸条件下与足量的KI溶液反应的化学方程式:
将该反应设计为原电池,负极电极反应为 ,当消耗1L 1.1mol/L KI溶液时,外电路通过电子数刚好为NA个,则该电池的化学能转化为电能的转化效率为 。
(3)为测定该磁流体中Fe2+的含量,取化学式为K1.5FeO2的样品2g溶解在稀硫酸中并稀释到100ml,取出2mL加入10ml 0.005mol/L的KMnO4(在酸性条件下KMnO4被Fe2+还原为Mn2+),充分反应后再加入150ml 0.001mol/L的FeSO4,溶液紫红色恰好完全褪色,则原样品中Fe2+的质量分数为 。溶解样品若选择稀硝酸测定结果 (填偏高,偏低,无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第 周期、第 族;PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
 (3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ;PbO2也可以通过石墨为电极,Pb(NO3)2 和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 ,这样做的主要缺点是 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ;PbO2也可以通过石墨为电极,Pb(NO3)2 和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 ,这样做的主要缺点是 。
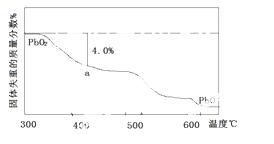
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(即样品起始质量—a点固体质量/样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2 ·nPbO,列式计算x值和m:n值 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表短周期的一部分,下列说法正确的是
A.元素①于第二周期第IVA族 B.气态氢化物的稳定性:④>②
C.单质⑤遇足量元素①的氢化物有白烟 D.元素的最高正化合价:③=⑤

查看答案和解析>>
科目:高中化学 来源: 题型:
对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.0.1mol·L-1的(NH4)2CO3溶液中:c(CO32-)>c(NH4+)>c(H+)>c(OH-)
B. 0.1 mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25℃时,1mol·L-1的CH3COONa溶液中:c(OH-)=c(H+)+c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com