
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
答案 D
解析 短周期元素X、Z形成的最低价离子为X2-、Z-,Y+和Z-具有相同的电子层结构,则X、Y、Z三种元素分别处于第ⅥA、ⅠA、ⅦA族。又知X和Y处于同一周期,Y+和Z-具有相同的电子层结构,从而推知X、Y、Z分别为S、Na和F。A项,原子最外层电子数:F>S>Na;B项,Na单质为金属晶体,S、F2为分子晶体,S为固体,F2为气体,显然沸点Na>S>F2;C项,具有相同电子层结构的离子,元素的原子序数越大,原子半径越小,Na+、F-具有相同的电子层结构,则离子半径:F->Na+,S2-多一个电子层,所以S2-半径最大;D项,三种元素的原子序数关系为S>Na>F。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知H和O可以形成H2O和H2O2两种化合物,试根据有关信息完成下列问题:
(1)水是维持生命活动所必需的一种物质。
①1 mol冰中有________mol氢键。
②用球棍模型表示的水分子结构是____________。


(2)已知H2O2分子的结构如图所示:H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。
试回答:
①H2O2分子的电子式是______________,结构式是________________________________________________________________________。
②H2O2分子是含有________键和________键的__________(填“极性”或“非极性”)分子。
③H2O2难溶于CS2,简要说明理由:________________________________________________________________________
________________________________________________________________________。
④H2O2中氧元素的化合价是__________,简要说明原因
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:________________________________________________________________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________,CO分子的结构式可表示成________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有________________,CH3OH的熔、沸点比CH4高,其主要原因是______________________________________。
(4)CH3CHO分子中,—CH3中的碳原子采取________杂化方式,—CHO中的碳原子采取________杂化方式。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z三种主族元素在元素周期表中的位置如图所示,设X的原子序数为a。则下列说法不正确的是( )
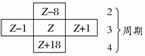
| Y | ||
| X | ||
| Z |
A.Y与Z的原子序数之和可能为2a
B.Y的原子序数可能为a-17
C.Z的原子序数可能为a+31
D.X、Y、Z一定为短周期元素
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)原子的最外层有2个电子的元素一定是ⅡA族元素( )
(2)元素所在的主族序数与最外层电子数之比为1的元素都是金属元素( )
(3)原子及离子的核外电子层数等于该元素所在的周期数( )
(4)原子最外层电子数大于3(小于8)的元素一定是非金属元素( )
(5)某元素的离子的最外层与次外层电子数相同,该元素一定位于第3周期( )
(6)最外层电子数等于或大于3(小于8)的一定是主族元素( )
(7)最外层有1个或2个电子,则可能是ⅠA、ⅡA族元素,也可能是副族、Ⅷ族元素或0族元素氦( )
(8)最外层电子数比次外层电子数多的元素一定位于第2周期( )
(9)某元素阴离子最外层电子数与次外层相同,该元素位于第3周期;若为阳离子,则位于第4周期( )
(10)电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期——“阴上阳下”规律( )
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.第ⅤA族与第ⅦA族的短周期元素的原子间构成的所有分子,其原子均满足最外层8电子结构
B.第ⅠA族元素单质熔沸点随着核电荷数的递增而升高
C.因为F的非金属性强于Cl的,所以HF的酸性强于HCl的
D.离子半径:r(S2-)>r(O2-)>r(Na+)>r(Al3+)
查看答案和解析>>
科目:高中化学 来源: 题型:
现有七瓶无标签的液体,可能是①乙醇、②乙酸、③苯、④乙酸乙酯、⑤油脂、⑥葡萄糖溶液、⑦蔗糖溶液,现通过以下步骤来确定各试剂瓶中所装液体的名称。
| 实验步骤和方法 | 实验现象 |
| Ⅰ.把7瓶液体分别依次标号A、B、C、D、E、F、G后闻气体 | 只有F、G两种液体没有气味 |
| Ⅱ.各取少量于试管中加水稀释 | 只有C、D、E三种液体不溶解而浮在水上层 |
| Ⅲ.分别取少量7种液体于试管中加新制的Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生红色沉淀 |
| Ⅳ.各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
给试剂瓶重新贴上标签:
A________、B________、C________、D________、E________、F________、G________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知亚硫酸钠在空气中能被氧气氧化生成硫酸盐。
Ⅰ.甲同学设计两种方案来检验Na2SO3溶液是否发生变质。
方案一:取样,加入稀盐酸有气泡生成,认为亚硫酸钠溶液没有变质。
方案二:取样,加入氯化钡溶液有白色沉淀生成,认为亚硫酸钠溶液完全变质。
请你对两方案作出评价:
方案一:________(填“合理”或“不合理”),理由是________________________________。
方案二:________(填“合理”或“不合理”),理由是___________________。
Ⅱ.乙同学探究Na2SO3溶液是否发生变质,设计如下实验测定1.0 mol·L-1 Na2SO3溶液的实际浓度。
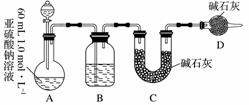
(1)分液漏斗中应加入足量的下列哪种试剂?________(填字母)
a.浓硝酸 b.65%硫酸 c.浓盐酸
(2)实验前后测得C装置增重3.2 g,则Na2SO3溶液实际的物质的量浓度为________。
(3)该实验装置还存在一个明显的缺陷是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com