
| A. | 氮分子的电子式: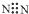 | B. | 硫原子的结构示意图: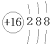 | ||
| C. | CO2的电子式: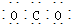 | D. | 水分子的结构式: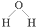 |
分析 A.氮气分子的电子式没写出氮原子上的孤对电子;
B.硫原子的核外电子数为16,最外层为6个电子;
C.二氧化碳中存在两个碳氧双键,不是碳氧单键;
D.1个水分子中含有2个氢氧共价键.
解答 解:A.N2为非金属单质,N原子之间有3各共用电子对,氮气正确的电子式为 故A错误;
故A错误;
B、硫原子的核外电子数为16,正确的原子结构示意图为 ,故B错误;
,故B错误;
C、CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其正确的电子式为 ,故C错误;
,故C错误;
D、1个水分子中含有2个氢氧共价键,则H2O的结构式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查化学用语的使用方法,题目难度中等,明确结构式、电子式的书写方法、原子结构示意图是解答本题的关键;电子式书写注意首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al13与Al14互为同素异形体 | |
| B. | Al13超原子中Al原子间是通过离子键结合的 | |
| C. | Al14与氢碘酸反应的化学方程式可表示为:Al14+2HI=Al14I2+H2↑ | |
| D. | Al13在一定条件下能和镁作用生成Mg(Al13)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:
草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com