
| Fe2+ | Fe3+ | Cu2+ | |
| 开始沉淀时pH | |||
| 完全沉淀时pH | 8 | 3.2 | 6.7 |
分析 (1)工业废水中含有重金属离子Cu2+,Cu(OH)2 KSP=2.2×10-23,CuS,KSP=6.3×10-36,溶度积常数可知需要将其转化沉淀除去的试剂是含硫离子的溶液;
(2)①QC=Ksp开始沉淀,所以亚铁离子开始沉淀时,符合c(Fe2+)•c2(OH-)=10-5×(10-6)2,所以c(OH-)=10-8mol/L,所以亚铁离子完全沉淀的PH=6;
铁离子开始沉淀时,符合c(Fe3+)•c3(OH-)=10-5×(10-10.8)3,所以c(OH-)=10-12.1mol/L,所以铁离子完全沉淀的PH=1.9;
铜离子开始沉淀时,符合c(Cu2+)•c2(OH-)=10-5×(10-7.3)2,所以c(OH-)=10-9.3mol/L,所以铁离子完全沉淀的PH=4.7;
②首先调节PH将铁离子完全除去,然后增加PH使铜离子完全沉淀,最后将亚铁离子分离子出来;
解答 解:(1)工业废水中含有重金属离子Cu2+,Cu(OH)2 KSP=2.2×10-23,CuS,KSP=6.3×10-36,溶度积常数可知需要将其转化沉淀除去的试剂是含硫离子的溶液,选择Na2S、K2S溶液生成CuS沉淀除去,
故答案为:Na2S、K2S溶液;
(2)①QC=Ksp开始沉淀,所以亚铁离子开始沉淀时,符合c(Fe2+)•c2(OH-)=10-5×(10-6)2,所以c(OH-)=10-8mol/L,所以亚铁离子完全沉淀的PH=6;
铁离子开始沉淀时,符合c(Fe3+)•c3(OH-)=10-5×(10-10.8)3,所以c(OH-)=10-12.1mol/L,所以铁离子完全沉淀的PH=1.9;
铜离子开始沉淀时,符合c(Cu2+)•c2(OH-)=10-5×(10-7.3)2,所以c(OH-)=10-9.3mol/L,所以铁离子完全沉淀的PH=4.7;故答案为:
| Fe2+ | Fe3+ | Cu2+ | |
| 开始沉淀时pH | 6 | 1.9 | 4.7 |
| 完全沉淀时pH | 8 | 3.2 | 6.7 |
点评 本题属于信息题的考查,侧重于考查学生的分析能力、实验能力,题目难度中等,做题时注意把握题给信息,注重知识迁移能力的培养.


科目:高中化学 来源: 题型:解答题
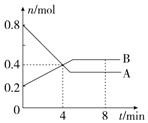 Ⅰ.某温度时,在2L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
Ⅰ.某温度时,在2L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
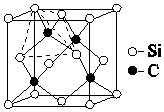 C和Si元素在化学中占有极其重要的地位:
C和Si元素在化学中占有极其重要的地位:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质的水溶液中不存在分子 | |
| B. | 纯水和干木头都不导电,但木头用水浸湿后却可以导电 | |
| C. | 某溶液的PH=7,该溶液一定呈中性 | |
| D. | 不溶性盐都是弱电解质,可溶性酸和强碱都是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4,酸性KMnO4溶液 | B. | 浓H2SO4,溴水 | ||
| C. | 溴水,浓H2SO4 | D. | 澄清的石灰水,浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
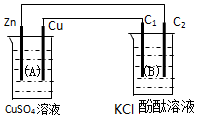 按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.
按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com