
分析 加热时NaHCO3分解,固体质量的变化是NaHCO3分解的缘故,可结合方程式用差量法计算,来原混合物中Na2CO3 和NaHCO3 的质量,从而求出各物质的物质的量.
解答 解:设混合物中含有xmolNaHCO3,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
2mol 62g
xmol 13.7g-10.6g=3.1g
所以$\frac{2}{x}=\frac{62g}{3.1g}$,解之得x=0.1mol,所以n(Na2CO3)=$\frac{13.7g-0.1mol×84g/mol}{106g/mol}$=0.05mol,
答:混合物中Na2CO3 和NaHCO3 的物质的量分别为0.05mol、0.1mol.
点评 本题考查混合物的计算,题目难度不大,注意差量法的运用.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| 实验方案 | 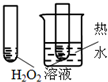 | 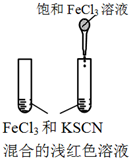 | 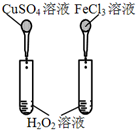 | 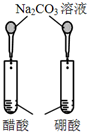 |
| 目的 | A.验证升高温度可加快H2O2分解 | B.验证增大反应物浓度对平衡的影响 | C.比较Cu2+、Fe3+对 H2O2分解速率的影响 | D.比较弱酸的 相对强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 131是这种碘-131的质量数 | B. | $\underset{131}{53}$I与$\underset{127}{53}$I互为同位素 | ||
| C. | 碘-131的中子数为53 | D. | 碘元素在周期表中位于第ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结论或目的 |
| A | 向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液呈红色 | 红砖中含有氧化铁 |
| B | CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液,溶液不显红色 | 黑色固体中没有Fe3O4 |
| C | 取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化,滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| D | 向某溶液中通入Cl2,然后再加入KSCN溶液变红色 | 原溶液中含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2O2固体中含有O22- 2NA | |
| B. | 常温常压下,3.2g CH4中含有电子2NA | |
| C. | 标准状况下,11.2L CH3CH2OH中含有分子0.5NA | |
| D. | 100mL 1mol•L-1的CH3COOH溶液中含有CH3COOH分子0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称取的质量NaOH/g | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它玻璃仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g),△H=-483.6kJ,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知OH-(aq)+H+(aq)═H2O(l)△H=-57.3kJ•mol-1,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 | |
| C. | 已知2C(s)+2O2(g)═2CO2(g)△H=a;2C(s)+O2(g)═2CO(g),△H=b,则a>b | |
| D. | 已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com